
题目列表(包括答案和解析)
4.下列分散系中的分散质的微粒直径属于纳米级(1~100nm)的是
A、溶液 B、悬浊液 C、胶体 D、 乳浊液
3.关于钠的说法正确的是
A、钠是银白色金属,硬度大
B、将钠放在石棉网上用酒精灯加热,钠剧烈燃烧产生黄色火焰,生成过氧化钠
C、钠在空气中燃烧生成氧化钠
D、钠的熔点很高
2.氯水用于消毒是因为
A、氯水中含有氯分子 B、氯水中含有次氯酸分子
C、氯水中含有氯离子 D、氯水中含有氢离子
1. 下列各组物质,前者是混合物,后者是纯净物的是( )
A、淀粉与氯化氢 B、钢与浓硫酸
C、纯碱与汽油 D、胆矾与液氯
25.已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案 基于假设3,设计出实验方案。 (3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
|
|
|
24.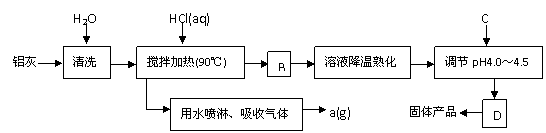 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
|
。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
23.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C的G处逸出的尾气中含有N2和少量C12,应如何处理?
。
22.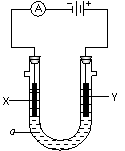 电解原理在化学工业中有广泛应用。右图表示一个电解池,
电解原理在化学工业中有广泛应用。右图表示一个电解池,
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式 ;
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
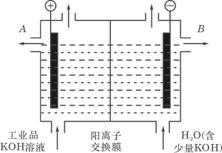
①该电解槽的阳极反应式是____________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因
___________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出。
21.右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
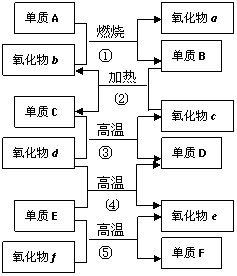
(1)写出下列物质的化学式:单质C ,氧化物d ;
(2)纯净的单质F在工业上的重要应用是 ;
(3)写出下列反应的化学方程式:
① ;
④ ;
⑤ 。
20.为研究和开发天然食用色素。某研究小组取等量相同品种的红枣,采用溶剂提取红枣中部分红色素,用紫外光谱仪测定不同温度下提取液的吸光度,实验结果见右图。已知吸光度越大,红色素含量越高。下列分析较合理的是
A.20℃时,红枣中红色素含量最低
B.吸光度越大,红枣中红色素含量越高 C.红色素可能在较高温度下不稳定
D.温度越高,提取液中红色素含量越高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com