
题目列表(包括答案和解析)
7.NA表示阿伏加德罗常数的值,下列叙述中正确的是:
A.Cu和足量的稀硝酸反应产生2.24 L气体时,转移的电子数为0.3NA
B.标准状况下,2.24 L丙烷中含有的非极性键数为0.3NA
C.常温常压下,4.4 g CO2和N2O的混合物中所含有的原子数为0.3NA
D.在1 L 0.2 mol·L-1的硫酸铁溶液中含有的铁离子数为0.4NA
6.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是:
|
|
① |
② |
③ |
④ |
⑤ |
|
甲 |
物质的粒子数 |
标准状况下气体摩尔体积 |
固体体积 |
溶液的质量分数 |
非标准状况下物质的质量 |
|
乙 |
阿伏加德罗常数 |
标准状况下气体的体积 |
固体密度 |
溶液的体积 |
物质的摩尔质量 |
A. ②③④ B。③④⑤ C。③④ D。③
5.下列溶液中能大量共存的离子组是:
A.加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br-
B.水电离产生的c(OH-)=1×10-12 mol·L-1的溶液中:NH、Na+、Cl-、HCO
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.在pH=1的溶液中:ClO-、NH4+、K+、Cl-
4.下列说法正确的是:
①萃取一定要在分液漏斗中进行;②用酒精灯加热试管内固体时,一定要先给试管预热再集中对准药品部位加热;③分离碘的CCl4溶液应使用蒸馏法;④用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部;⑤稀释浓硫酸时,把水慢慢倒入盛有浓硫酸的烧杯中;⑥配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出;⑦检测某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
A.①②④⑤⑦ B.①②③④⑥ C.①④⑦⑥ D. ②③④
3.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于Y的说法不正确的是:
A.钇元素属于金属 B.质子数与中子数之差为50
C.位于周期表第5周期 D. Y和Y是两种不同的核素
2. 实现下列变化需要加入还原剂才能实现的是( )
A.Fe2O3 →Fe B.Cu →Cu(NO3)2
C.SO3→ H2SO4 D.Cl2→Cl-
1.下列有关物质分类的说法中正确的是
A.石英玻璃、普通玻璃都属于硅酸盐产品
B.乙烯、乙醇都是纯净物
C.煤、石油都属于可再生能源
D.纯碱、烧碱都属于碱类物质
21.(10分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO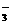 还原为N2,从而消除污染。其反应的离子方程式是:
还原为N2,从而消除污染。其反应的离子方程式是:
6NO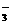 +10Al+18H2O→3N2↑+10Al(OH)3+6OH-
+10Al+18H2O→3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下33.6L氮气时,转移韵电子为
mol。现在要除去1m3含氮元素0.3mol的废水中的N0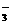 (设氮元素都以NO
(设氮元素都以NO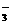 的形式存在,下同),则至少需要消耗金属铝
g。
的形式存在,下同),则至少需要消耗金属铝
g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同,。
①写出镁和含氮废水反应的离子方程式
②已知金属镁可以从海水中提取的MgCI2通过电解制得的,电解熔融氯化镁的化学方程式为
,若要除去1m3含氮元素0.3mol的废水中的NO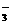 ,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
,则至少需要含0.5%(质量分数)MgCl2的海水 kg。
0.9mol。则浓硫酸的实际体积____ (填写“大于”、“等于”、或“小于”)100mL,你认为其主要原因是 。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈
绿色,后者呈蓝色,某同学提出这可能是溶液中Cu2+与NO2共存的结果,请你设
计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
20.(10分)盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反
应情况,填空回答下列问题:]
(1)我们知道,稀盐酸不与Cu反应,但在稀盐酸中加入H2O2后,则可使铜顺利溶解,该反应的化学方程式为_ 。
(2)在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com