
题目列表(包括答案和解析)
17.(15分)某无色透明溶液可能含有下列离子K+、Al3+、Fe3+、Ba2+、NO、SO、HCO、Cl-中的一种或几种,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)。
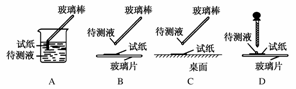
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②和③两个实验有关的离子方程式:
②________________________________________________________________________。
③________________________________________________________________________。
16、(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
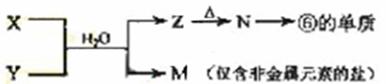
X溶液与Y溶液反应的离子方程式为__________________ ___,
N→⑥的单质的化学方程式为____________ _。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
15、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的浓度相等)。则下列分析推理中不正确的是
|
|
50mL盐酸 |
50mL盐酸 |
50Ml盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A、盐酸的物质的量浓度为3.0 mol/L
B、根据表中数据能计算出混合物中NaHCO3的质量分数
C、加入混合物9.2 g时盐酸过量
D、15.7 g混合物恰好与盐酸完全反应
第二卷 非选择题( 55分)
14.下列关于溶液和胶体的叙述,正确的是( )
A. 溶液是电中性的,胶体是带电的
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
13. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4 B.1:5 C. 2:3 D.2:5
12.把a L硫酸铵和硝酸铵混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2。原则溶液中NO的物质的量浓度是:
A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1
11.如图为实验室制氢气的简单装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应能顺利进行,则可以从长颈漏斗中加入的试剂是:
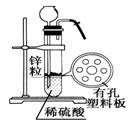
①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤ B.②⑥ C.①②③⑤ D.①②④
10.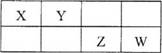 右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8。下列说法不正确的是
右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8。下列说法不正确的是
A.Z的气态氢化物和Z的最高价氧化物的水化物的浓溶液反应可生成单质Z
B.原子半径由大到小的顺序为:Z>W>X>Y
C.Y元素可形成多种氧化物
D.Z的氢化物比W的氢化物稳定
9.下列叙述中正确的是:
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.元素的性质随原子最外层电子数增加而呈周期性变化
C.在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈
D.在IA族中,单质的熔、沸点随着原子半径的增大而逐渐升高
8.下表中评价合理的是
|
选项 |
化学反应及离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应:2Fe3O4 + 18H+ = 6Fe3+
+H2↑ +8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸:CO32- + 2H+ = CO2↑ + H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液:Ba2+ + SO42-=BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2反应: 2Fe2+ + 2Br- + 2Cl- = 2Fe3+ + 4Cl- + Br2 |
错误,Fe2+与Br-的化学计量数之比应为1:2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com