
题目列表(包括答案和解析)
4.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2mol FeSO4发生反应时,共有10mol电子转移
3.下列反应的离子方程式书写正确的是( )
A.亚硫酸氢铵溶液与等物质的量的NaOH溶液混合:
NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
B.漂白粉溶液中通入适量的SO2气体
Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
AlO2-+4H+ =Al3++2H2O
D.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+OH-=CaCO3↓+H2O
2.下列各组物质的溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是( )
A.AgNO3 NaCl BaCl2 NaOH B.K2CO3 KHCO3 HCl H2SO4
C.Na2CO3 NaHSO4 Ba(NO3)2 KCl D.KNO3 NaCl BaCl2 (NH4)2SO4
1.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2 ②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH ⑥HO-CH2-CH2-OH中,符合题意的是( )
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
(1)检验纯碱中是否混有食盐的试剂是 ;
(2)证明纯碱中混有小苏打的实验方法是 。
29.(12分)已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉-碘化钾溶液。请完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: 。
假设2方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
(1)当石灰水过量时,反应的离子方程式为 。
(2)当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为 。
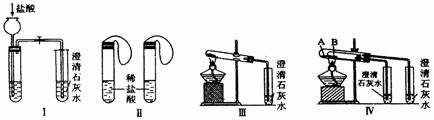
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是 ,能说明碳酸钠比碳酸氢钠稳定的实验现象是 。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号) 。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是 。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?若能,请说明其计算所需的数据 ;若不能,请简要说明理由 。
 1 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第二卷(非选择题,55分)
16(14分,每空2分)
(1)________________________ _。
(2)______________________ ___。
(3)__________________ __。
(4)________________ _。
(5)__________________ ___,
____________ _。
_______________ __。
17(15分,每空3分)
(1) ________ (填代号)。
(2) _______ _,
______ _ 。
(3) ②________________________________________________________________________。
③________________________________________________________________________。
|
18(12分,每空3分)
(1) _______________________________ _________;
(2) _______ _g;
(3)
。
(4) (填序号)
19(15分,(1)小问共3分,其余每空3分)
(1)______KIO3+______KI+______H2SO4===______K2SO4+_____I2+_____H2O
(2) ①__________________________ ____。
②____________________________ __。
(3) ①________ 。
②__________________________mg/kg。
19.(18分)某市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以Ⅰ计) |
20-50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
______KIO3+______KI+______H2SO4===______K2SO4+_____I2+_____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________ _____。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2S2O===2I-+S4O。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2SO3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是________。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)__________________________mg/kg。
祁阳四中2010年下学期高三第一次月考化学试题答卷
第一卷 (选择题,45分)
18、(12分)实验室需要配制0.5 mol·L-1的烧碱溶液480 mL,根据溶液实际配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:________________________________________;
(2)根据计算得知,所需NaOH固体的质量为________g;
(3)配制溶液的定容操作时,先缓缓地把蒸馏水直接注入容量瓶中,当液面接近刻度线1cm∽2cm处时,停止用烧杯直接注水,完成后期加入那部分少量水的操作方法是:
。
(4)如果在配制过程中出现下列操作,则所配得的溶液浓度偏低的有 (填序号)
A.称量NaOH的质量时,错把砝码和NaOH的位置颠倒了
B.定容时,俯视刻度线
C.未将烧杯和玻璃棒进行洗涤
D.定容后摇匀发现液面低于刻度线,继续滴加蒸馏水至刻度线
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com