
题目列表(包括答案和解析)
5、下列各组元素的电负性大小次序正确的是( )
A、S<N<O<F B、S<O<N<F
C、Si<Na<Mg<Al D、Br<H<Zn
4、下列各分子中,所有原子都满足最外层为8电子结构的是( )
A. H2O B. BF3 C.CCl4 D.PCl5
3、以下说法中正确的是( )
A、玻尔的原子轨道模型可以解释大多数原子的线状光谱的形成原因。
B、线状光谱特征谱线对应的光的频率与原子中能级之间的能量差可表示为hμ=|Ej-Ei|
C、氢原子的1s电子云是平面圆形,其中的每一个小黑点代表一个电子。
D、在s轨道上运动的所有电子的能量是相同的。
2、现有带电玻璃棒靠近下列液体的细流,细流会发生偏转的是( )
A、Br2 B、CS2 C、CH3Cl D、CCl4
1、下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量高的电子在离核近的区域绕核旋转
29.(8分 )科学家用NaNO3和Na2O在一定条件下等物质的量化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 , A 与Na3PO4比较,其稳定性A Na3PO4(填“>”或“<”),阴离子B的空间结构最有可能是 (填 序号);
①直线型 ②平面三角形 ③三角锥形 ④正四面体
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为 ,其与水反应生成过氧化氢的离子方程式为 ,该反应 (填“是”或“不是”)氧化-还原反应。
平川中恒学校高三10月月考
28.(15分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+、Mg2+、Al3+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是
A ;B ;C ;D ;E 。
。
27.(13分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为___________。
(2)写出该反应的化学方程式,用双线桥标出电子转移的方向和数目:
___________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为___________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种钠盐:______ ______(填化学式)。
26.(14分))实验室用密度为1.25g/mL,质量分数为36.5%浓盐酸配制250mL 0.1mol/L的稀盐酸溶液,填空并请回答下列问题:
(1)浓盐酸的物质的量浓度为
(2)配制250mL 0.1mol/L的盐酸溶液
|
应量取浓盐酸体积/mL |
应选用容量瓶的规格/mL |
|
|
|
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤 2-3次,洗涤液均注入容量瓶,振荡。
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀。
C.将已冷却的盐酸沿玻璃棒注入容量瓶中。
D.将容量瓶盖紧,振荡,摇匀。
E.改用 加水,使溶液凹面恰好与刻度相切。
F. 继续往容量瓶内小心加水,直到液面接近刻度线 处。
(4)操作A中,将洗涤液都移入容量瓶,其目的是
(5)若实验过程中出现如下情况如何处理?
Ⅰ、加蒸馏水时不慎超过了刻度线 。
Ⅱ、向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面
25.已知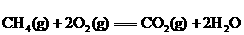 (1) △H=-890.3 kJ·
(1) △H=-890.3 kJ· ,现有
,现有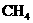 和CO的混合气体共0.75 mol,完全燃烧后,生成
和CO的混合气体共0.75 mol,完全燃烧后,生成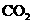 气体和18 g液态水,并放出515.9
kJ热量,则CO燃烧的热化学方程式是 ( )
气体和18 g液态水,并放出515.9
kJ热量,则CO燃烧的热化学方程式是 ( )
①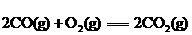 △H=-566 kJ·
△H=-566 kJ·
② △H=-283 kJ·
△H=-283 kJ·
③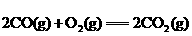
△H=-374.4 kJ·
△H=-374.4 kJ·
④ △H=+1406.2KJ·
△H=+1406.2KJ·
A.①② B.①③ C.②④ D.③④
第Ⅱ卷(非选择题,共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com