
题目列表(包括答案和解析)
40.5g。则原混合物中氯化铵与消石灰的物质的量之比为
A 等于2︰1 B 大于2︰1 C 小于2︰1 D等于1︰1
二:非选择题(共60分)

8.氯化铵晶体与消石灰固体混合物90.5g,在150℃下加热至质量不再减少为止,得到残渣
7.已知H2(g)+I2(g)  2HI
(g) △H <0,有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各1mol
,乙中加入HI 2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI
(g) △H <0,有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各1mol
,乙中加入HI 2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入1mol He,乙不变
C.甲降低温度,乙不变 D 甲增加1mol H2,乙增加1mol I2
6.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
5.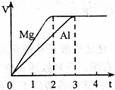 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
A.质量之比为3:2
B.摩尔质量之比为2:3
C.物质的量之比为3:2
D.反应速率之比为2:3
第1页
4. X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期, R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
19、(16分)
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的两元素化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为 ,W3分子空间构型为 ;
(2)X单质与水发生主要反应的化学方程式为 ;
(3)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O-C-O的键角约为 ;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z= ;
(5)含有元素Z的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
18.(10分)A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
⑴分别写出三只烧杯中形成分散系的名称:
A , B ,C 。
⑵写出B中形成分散系的离子方程式 。
⑶写出C中形成分散系的化学方程式 。
17、(10分)第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A与B的次外层电子数为8,而C与D次外层电子数为18,根据结构填空:
(1)写出元素名称:A ,B ,C ,D 。
(2)D的简单离子是 。
(3)元素的氢氧化物碱性最强的是 。
(4)B与D二原子间能形成化合物的化学式是 。
(5)写出A、B的电离能顺序 。
(6)写出C基态原子的电子排布式 。
16.(4分)过量铁粉与稀硝酸反应的方程式为:
Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O
(1)请写出上述反应配平的离子方程式 ;
(2)标准状况下,当生成2.24L NO气体时,转移电子的物质的量为 ,有 mol氧化剂被还原。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com