
题目列表(包括答案和解析)
15.CaCO2溶于盐酸生成CO2,则下列说法中正确的是 ( )
A.该反应的离子方程式为CO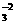 +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.与同浓度盐酸反应,块状大理石的反应速率比粉末状的快
C.CaCO2溶于盐酸是因为H+破坏了CaCO2的沉淀溶解平衡,使CaCO3的Ksp增大
D.CaCO2与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH)+2c(CO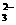 )+c(HCO
)+c(HCO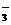 )
)
14.右图为室温下20 mL一定物质的量浓度的盐酸,用一定物质的量浓度的NaOH溶液滴定的图示,据图推出盐酸和NaOH溶液的物质的量浓度(mol·L-1)分别是 ( )
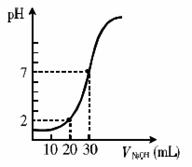
|
|
A |
B |
C |
D |
|
c(HCl)(mol·L-1) |
0.06 |
0.04 |
0.03 |
0.09 |
|
c(NaOH)(mol·L-1) |
0.04 |
0.06 |
0.09 |
0.03 |
13.电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质常用于制造太阳能电池,w的原子半径是同周期中最小的。下列推断中正确的是 ( )
A.Z的氢化物的热稳定性强于w的氢化物
B.z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的离子半径依次增大
D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应
12.Li-SO2电池具有输出功率高和低温性能好等特点,其电解质是LiBr,溶剂是碳酸丙烯酯和乙睛,电池反应为2Li+2SO2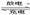 Li2S2O4。下列说法正确的是 ( )
Li2S2O4。下列说法正确的是 ( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e-===Li
D.该电池的电解质溶液可以换成LiBr的水溶液
11.盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
己知:①H2O(g)=====H2O(l) △H1===Q1kJ·mol-1
②C 2H 5OH(g)====C2H 5OH(l) △H2====Q 2 kJ·mol-1
③C 2 H 5 OH(g)+3O2(g)--2CO2(g)+3 H 2 O(g) △H3====Q 3 kJ·mol-1
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )
A.Q1+Q2+Q3
B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3
D.0.5(Q1+Q2+Q3)
10.下列关于有机物的说法中,不正确的是 ( )
A.糖类、油脂和蛋白质在一定条件下都能发生水解反应
B.2,5一二甲基己烷的核磁共振氢谱中会出现三组峰
C.甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应
D.分子式为C5H12的有机物只有三种,它们属于同分异构体
9.下述实验不能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
|
B |
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 |
比较氯与溴的氧化性强弱 |
|
C |
将铜片分别与浓、稀硝酸反应 |
探究浓、稀硝酸氧化性的相对强弱 |
|
D |
向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌。 |
探究浓硫酸的脱水性 |
8.下列溶液中有关物质的量浓度关系和计算不正确的是 ( )
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa)
B.已知25°C时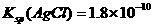 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到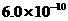 mol·L-1
mol·L-1
C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有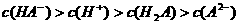
7.下列有关结构和性质的说法中,正确的是 ( )
A.元素非金属性Cl>S的实验依据是酸性HCl>H2S
B.碳元素的电负性小于氧元素,每个CO2分子中有4个σ键
C.同周期主族元素的原子形成的简单离子的电子层结构一定相同
D.Na、Mg、Al三种元素,其第一电离能由大到小的顺序为Mg>Al>Na
6.设阿伏加德罗常数为N。。则下列说法正确的是 ( )
A.7.1g Cl2与足量NaOH溶液充分反应后,转移的电子数为O.1 NA
B.1.0L浓度为1.0 mol·L-1的一元酸溶液中含有的氢离子数为1.0 N2
C.常温下,1L 0.1 mo1.L-1的NH4NO2溶液中氮原子数小于0.2 NA
D.标准状况下,22.4L乙醛中含有的氧原子数为1.0 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com