
题目列表(包括答案和解析)
1.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做 ( )
A.阴极 B.阳极 C.正极 D.负极
21.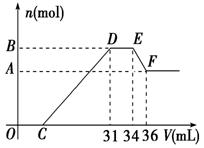 (14分)已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。则:
(14分)已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。则:
(1)试写出DE段、EF段所发生反应的离子方程式:
DE段
EF段
(2)合金中铝的物质的量为 mol
(3)合金中金属的物质的量共为 mol
(4)求出C点的值为 ml
吉安一中2010-2011年度上学期第二次段考
20.(12分)汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。 取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。 请回答下列问题: (1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。 A. KCl B. KNO3 C. Na2S D. CuO
19.(8分)有机物A、B、C的分子式均为C5H8O2,其部分结构或性质如下表:
|
有机物 |
A |
B |
C |
|
部分结构或性质 |
五元环状化合物 |
分子中含有一个甲基,且能使溴的四氯化碳溶液褪色 |
碳链无支链,1molC发生银镜反应时生成4 mol Ag |
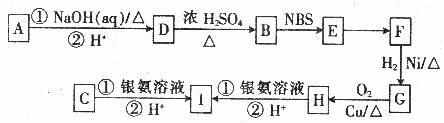 有机物A、B、C有如图所示的转化关系:
有机物A、B、C有如图所示的转化关系:
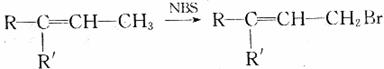
已知:
请回答下列问题:
(1)A的结构简式为
(2)D转化为B的过程中,生成的一种能使溴的四氯化碳溶液褪色的副产物的结构简式为
(3)E转化为F的反应条件为
(4)写出C与足量的银氨溶液反应的化学方程式:
18.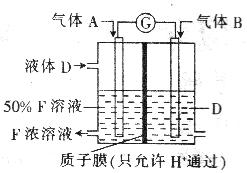
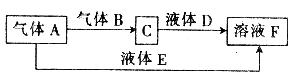 (6分)甲、乙、丙、丁是原子序数依次增大的短周期元素,甲与丙、乙与丁分别同主族,甲、丙均可与乙形成原子个数之比为1:1和2:1的化合物。由甲、乙、丁中的一种或几种元素可组成下列转化关系中的所有物质。
(6分)甲、乙、丙、丁是原子序数依次增大的短周期元素,甲与丙、乙与丁分别同主族,甲、丙均可与乙形成原子个数之比为1:1和2:1的化合物。由甲、乙、丁中的一种或几种元素可组成下列转化关系中的所有物质。
请回答下列问题:
(1)丙元素的离子结构示意图为
(2)E的电子式为
(3)科学家提出设想,以右上图所示装置利用电化学原理生产溶液F,写出通入气体A的一极的电极反应式:
17.(12分)北京2008年奥运会金牌直径为70 mm,厚6 mm。奖牌正面为插上翅膀站立的希腊胜利女神和希腊潘纳辛纳科竞技场。奖牌背面镶嵌着取自中国古代龙纹玉璧造型的玉璧。
(1)环形玉璧由白玉制成。白玉的化学成分可简单看作是Ca2Mg5Si8O22(OH)2,将其改写成氧化物的形式为________________。
(2)为测定金牌的组成,将某去掉白玉的金牌样品,投入到过量稀硝酸中,有无色气体产生,当不再生成气体时,金牌残留一金黄色外壳;将生成的气体与11.2 L O2(标准状况)混合即呈红棕色,最后将其通入水中,所有气体完全被水吸收生成硝酸;再向金牌溶解所得的溶液中滴加氯化钠,立即产生白色沉淀;最后将残壳投入到王水中,随即溶解,生成气体的体积为1.344 L(标准状况)。已知:Au+HNO3+4HCl===H[AuCl4]+NO↑+2H2O。
①该金牌所含黄金质量为________。
②该金牌除含黄金外还含有另一金属是________(填元素符号),其质量为________。
(3)黄金除能溶于王水外还能溶于氰化钾,反应方程式如下:
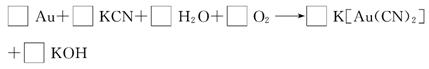
①配平该反应,并将计量数填入方框内。
②K[Au(CN)2]可作为电镀金的电镀液,金牌表面的黄金就是通过电镀镀上的。在电镀金牌时,阴极反应式为________________________________。
16. 难挥发性二硫化钽(TaS2)可采用如右图装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
难挥发性二硫化钽(TaS2)可采用如右图装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2(s)+2I2(g)
TaI4(g)+S2(g)
TaS2(s)+2I2(g)
TaI4(g)+S2(g)
下列说法正确的是( )
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
第Ⅱ卷(非选择题,共52分)
15.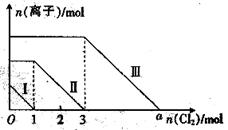 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a数值等于6
D.原混合溶液中n(FeBr2)=4 mol
14.关于下列图示的说法中不正确的是( )
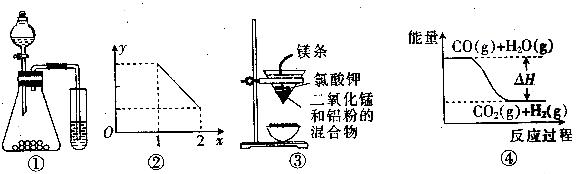
A.用图①实验装置可完成比较乙酸、碳酸、苯酚三者酸性强弱的实验
B.图②表示NOx溶于水完全转化为HNO3时,x与耗氧量y之间的关系
C.用图③装置可制得金属锰
D.图④表示可逆反应CO2 (g)+H2 (g)
 CO(g)+H2O(g)的△H<O
CO(g)+H2O(g)的△H<O
13.一定温度下,有可逆反应:3Fe(s)+4H2O(g)Fe3O4 (s)+4H2O;△H>O。下列说法中正确的是( )
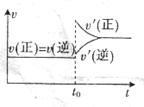 A.降低反应温度,H2O(g)的转化率增大
A.降低反应温度,H2O(g)的转化率增大
B.反应达到平衡后,增加Fe的量,平衡向正反应方向移动
C.反应达到平衡后,t0时增大压强,V(正)、V(逆)的变化如右图所示
D.在绝热密闭容器中,若体系温度不再发生变化,则说明该反应达到化学平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com