
题目列表(包括答案和解析)
12.等体积、等物质的量浓度的硫酸、氢氧化钠溶液被分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量 B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量 D.甲中酸过量,乙中碱过量
11.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况)(不考虑NO2与N2O4的相互转化),则反应中消耗HNO3的物质的量为 ( )
A.1mol B.0.05mol C.1.05mol D.0.11mol
10.将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是 ( )
A.Fe2O3 B.Fe(OH)3 C.Fe2(SO4)3 D.FeO
9.将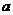 mol钠和
mol钠和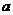 mol铝一同投入
mol铝一同投入 g足量水中,所得溶液密度为
g足量水中,所得溶液密度为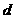 g·mL-1,该溶液中溶质质量分数为 ( )
g·mL-1,该溶液中溶质质量分数为 ( )
A. B.
B. % C.
% C.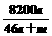 % D.
% D.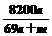 %
%
8. 下列反应的离子方程式正确的是 ( )
A.过量二氧化碳通入偏铝酸钠溶液中:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:
NH4+ + HSO3- +2OH-=SO32- +NH3↑+2H2O
C.氯气通入冷的烧碱溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O
D.碳酸氢镁溶液中加入过量的石灰水:
Mg2++2HCO3- +Ca2+ +2OH-=CaCO3↓+2H2O+MgCO3↓
7.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g镁与CO2气体完全反应转移的电子数为0.2NA
B.1molC5H12分子中共价键总数为13NA
C.在标准状况下,2.24L 四氯化碳所含的分子数为0.1NA
D.2L 0.1mol/L 的醋酸钠溶液中,所含醋酸根离子数是0.2NA
25.(14分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
|
阳离子 |
Ag+ Na+ |
|
阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。
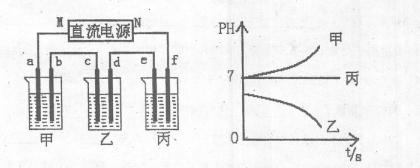
接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 :极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)写出d电极上发生反应的电极反应式 .
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出则该溶液常温时的pH为 。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成原电池,请写出正极的电极反应式: .
(5)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
24.(12分)某芳香族化合物A的分子式为C9H9O2C1,A在一定条件下有如图所示的转化关系,A分子中苯环上有两个取代基,且A能与碳酸氢钠溶液反应生成气体,C能发生消去反应,D能发生银镜反应,E中除苯环外还含有一个六元环,。其蒸气密度是相同条件下H2密度的74倍。
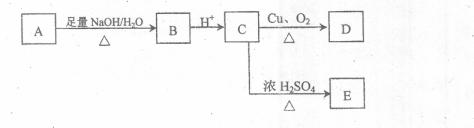
(1)A的结构简式是 。
(2)关于上图各步转化中涉及到的反应类型有 。
a.加成 b.取代 c.酯化 d.氧化。
(3)请写出C→D的化学方程式
C→E的化学方程式
(4)写出一种符合下列要求的E的同分异构体的结构简式:
①分子中苯环上有三个取代基,且苯环上的一氯代物有两种
②l mol该有机物与足量银氨溶液反应能产生4 mol Ag。
(5)C在一定条件下能生成高分子化合物,写出该反应的化学方程式:
23.(12分)利用右图装置测定中和热的实验步骤如下: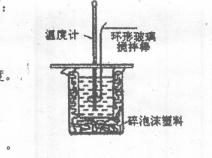
①量取50mL0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)碎泡沫塑料的作用是 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入
C.分三次加入
(3)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数
|
温度 实验次数 |
起始温度t1/℃ |
终止止温度t2/℃ |
温度差(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
(4)若将上述实验步骤中酸和碱的体积都变为60 mL,则放出的热量与上述实验中放出的热量相比 (填变大、变小或不变),中和热 (填变大、变小或不变);若将酸和碱的体积都变为5 mL,则对该实验的主要影响是 。
22.(10分)能源短缺是人类社会面临的重大问题。’甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
 反应I:CO(g)+2H2(g) CH3OH(g) △H1
反应I:CO(g)+2H2(g) CH3OH(g) △H1
 反应,II:CO2(g)+3H2(g); CH3OH(g)+H2O(g) △H2
反应,II:CO2(g)+3H2(g); CH3OH(g)+H2O(g) △H2
①上述反应较符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,2min后达到平衡,测得c(CO)=0.2 mol/L,则H2的反应速率为 ,CO的转化率为 。
③已知反应I正反应为放热反应,且该反应中,断裂Imol CO(g)中的键吸收akJ热量,断裂1mol m(g)中的键吸收bkJ热量,断裂CH3OH(g)中的lmol碳氢键、lmol氧氢键和lmol碳氧键分别吸收ckJ、dkJ和ekJ热量.
则△H1= (用a、b、C、d、e表示)。
(2)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②H2O(g)=H2O(1) △H=-44.0kJ/mol
则甲醇的燃烧热为: ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com