
题目列表(包括答案和解析)
28.(14分)(1) ①Fe2+ ; Fe3+、Cu2+ (2分)
2Fe3+ +Fe =3Fe2+ Cu2+ + Fe =Fe2+ +Cu(2分)
② Fe2+ ;Cu2+ 0≤n(Cu2+)<0.1mol (4分)
③ Fe2+ 、Cu2+ (2分)
⑵ ①沉淀全是Fe(OH)3为0.06mol(2分)
②0≤X≤0.6 (2分)
27.(15分) ⑴ A: NaHCO3 B:Na2CO3 C:CO2 E:Na2O2 F:NaOH(5分)
⑵ ①2NaHCO3= Na2CO3 + CO2↑+H2O(2分)
② 2CO2 + 2Na2O2= Na2CO3 +O2 (2分)
④NaHCO3+ NaOH = Na2CO3 +H2O(2分)
⑤Na2CO3 +CO2+H2O =2NaHCO3 (2分)
⑶ 供氧剂﹑漂白剂(或氧化剂)(2分)
26.(14分)(1) 铁和稀硫酸;(2分) (2) 氢氧化钠溶液。(2分)
(3) ①打开弹簧夹C;(2分) ②反应一段时间后关闭弹簧夹C;(2分);
(4)A中液体被压入到B瓶,(1分);B瓶内生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色;(1分)
Fe2++2OH--=Fe(OH)2(2分);4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
37.[化学--选修有机化学基础](15分)
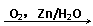 环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
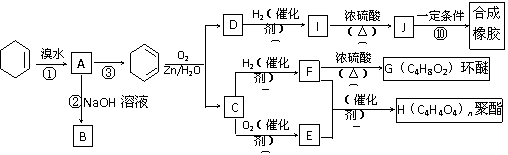 已知:R1-CH=CH-R2
R1-CHO+R2-CHO
已知:R1-CH=CH-R2
R1-CHO+R2-CHO
⑴F的名称是___________,C中含有的官能团的名称是______________。(2分)
⑵③的反应条件是_________________________。(2分)
⑶写出下列有机物的类别:A______________,E_______________。(4分)
⑷写出下列反应类型:⑥_________________,⑨______________。(4分)
⑸写出⑩反应的化学方程式: 。(2分)
⑹有机物B和I的关系为____________(填序号,多填扣分)(1分)
A. 同系物 B. 同分异构体 C. 都属于醇类 D. 都属于烃
化学部分:
选择题: 7.A 8.A 9.C 10.D 11.D 12.B 13.B
36.[化学--选修物质结构与性质](15分)
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置 ;(2分)
D元素基态原子电子排布式为_____________________________。(2分)
(2)E的气态氢化物在同族元素中沸点最高的原因是:
。(2分)
(3)A、C两元素第一电离能 > 。(填元素符号)(2分)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是 的原子。(2分)
(5)A元素可与氢元素形成离子化合物,电子式为_______________;(2分)这种离子化合物可与水反应,化学方程式为________________________________。(3分)
35.[化学--选修化学与技术](15分)
羟基磷灰石[Ca5(PO4)3OH]是一种一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。

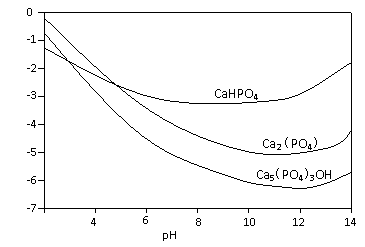
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5 Ca(NO3)2 + 3(NH4)2HPO4 + 4NH3·H2O = Ca5(PO4)3OH↓+ + (2分)
②5Ca(OH)2 + 3H3PO4 = (2分)
(2)与方法A相比,方法B的优点是 。(3分)
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。(3分)
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。(2分)
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。(3分)
28.(14分)(1)现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。(2分)有关反应的离子方程式是__________________________
__________________________________________________________。(2分)
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是: ______________________。(4分)
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。(2分)
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol。在此溶液中加入90 mL 4 mol / L的NaOH溶液,使其充分反应;设Al3+ 的物质的量与总物质的量的比值为x。
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。(2分)
②计算沉淀中只有Fe(OH)3时的x的取值范围:_____________________。 (2分)
化学选考题(15分)
27. (15分)下列图中A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,G是一种常见单质。
(15分)下列图中A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,G是一种常见单质。
①A(固体) B + C + D ②C + E → B + G; ③ D + E → F + G
④A(溶液)+F(溶液)→B(溶液)+D ⑤B(溶液) + C + D → A(溶液)
(1)写出A﹑B﹑C﹑E﹑F的化学式:A__________ B_________ C__________
E__________ F__________(5分)
(2)写出反应①②④⑤的化学方程式:
①_________________________________________________(2分)
②_________________________________________________(2分)
④_________________________________________________(2分)
⑤_________________________________________________(2分)
(3)请写出化合物E的两种重要用途:____________________________(2分)
26.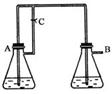 (14分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用右图装置使用Fe,H2SO4(稀),NaOH溶液可在还
(14分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用右图装置使用Fe,H2SO4(稀),NaOH溶液可在还
原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其
中C为弹簧夹。(提示:还原性气氛如氢气环境)
(1)则锥形瓶A中应加入的药品为_________________.(2分)
(2)锥形瓶B中应加入的药品为__________________.(2分)
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2
的后续操作步骤。
①_____________________ ②_______________________________。(4分)
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:
;(2分)
请写出此时B瓶中发生的化学反应的离子方程式:
;(4分)
13. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的
质量与加入的NaOH溶液体积的关系如右图所示,由此确定,
原溶液中含有的阳离子是: ( )
A.Mg2+、Al3+、 Ba2+
B.H+、Mg2+、Al3+
C.H+、Cu2+、Al3+
D.只有Mg2+、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com