
题目列表(包括答案和解析)
21.(8分) 化学实验小组将不同质量的镁铝合金与一定量的盐酸反应,通过测量反应过程中生成气体的体积,从而测定合金的组成和盐酸的浓度。
实验操作:在甲、乙、丙三只反应器中,分别加入相同体积相同浓度的盐酸,然后分别慢慢加入组成相同、质量不同的镁铝合金粉末,测量产生的气体体积。
实验数据:(气体体积已换算成标准状况下)
|
实验序号 |
甲 |
乙 |
丙 |
|
盐酸体积/ mL |
30.0mL |
30.0mL |
30.0mL |
|
合金质量/ mg |
255 |
385 |
459 |
|
气体体积/ mL |
280 |
336 |
336 |
数据处理:(假设反应前后溶液体积不发生变化)
(1)判断甲组实验盐酸是否过量的方法是 ▲ ;
(2)实验中所用盐酸的物质的量浓度为 ▲ ;
(3)计算合金中Mg、Al的质量之比(写出计算过程)。
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
-- |
-- |
4.7 |
-- |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
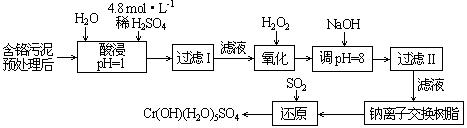
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 ▲ 。
(2)酸浸时,为了提高浸取率可采取的措施是 ▲ (至少一条)。
(3)加入H2O2的作用是 ▲ 。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是
▲ (选填:Fe3+、Al3+、Ca2+、Mg2+)。
26.(1) ① 。
② 。 。
③ 。
(2) 。
(3)
(4) ;
。
2010学年度
25.(1)______________________________________________
(2)、 , ;
,
(3) _________________ _______________________
(4) __________ ________
(5)________ 和 _____________
(6)________________________________________ ,______________ ____________
24、(1) (2) (3) _________ _____。
(4) ①
② , 。
③
。
22.
(1)__________________________________ ___ __
(2) ________ _________ ;
(3) __________________________________ ______
(4) __________________
23,
(1)A C D E
(2) ______________ ________________
(3) ______________ ;
21.(1)_________
(2) _________ _________
(3) _________ _________
20.《有机化学基础》选做题(13分)
将羧酸的碱金属盐电解可得到烃类化合物。例如:
2CH3COOK+2H2O CH3-CH3+2CO2↑+H2↑+2KOH
CH3-CH3+2CO2↑+H2↑+2KOH
请根据下列表示的衍变关系,回答问题。
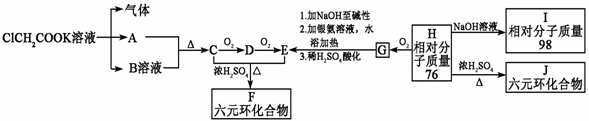
(1)写出下列物质的结构简式A: E:
(2)G能发生反应的类型有(填序号):
a. 加成 b.还原 c.氧化 d.消去 e.水解
(3)写出H的最简单的两种同系物的结构简式 , 。
(4)F与J的关系为
a.同一物质 b.同系物 c.同分异构体 d.同素异形体
19.、《化学与生活》选做题(13分)
(1)由于人的胃里有_____________,因此胃液分泌过多会引起胃病,服用含氢氧化铝的药物可缓解病痛,其治疗的化学原理为(用离子方程式表示)_____________。
(2)做馒头发酵面团时,会产生乳酸等有机酸,蒸馒头前需加进适量的_______等碱性物质,它们相互作用产生了CO2气体,使蒸发的馒头疏松多孔;若加进碱性物质过多,可向面团或蒸锅中滴加少许含_____________(填化学式)的酸性调味料,否则蒸出的馒头会变涩,颜色变黄。
(3)市场上出售的紫葡萄,表皮上常附着一些浅蓝色的斑点,它是为防治霉菌而喷洒的农药波尔多液。波尔多液中含有一种有毒的盐,因此在吃葡萄之前,应将葡萄浸泡在水中一段时间。这种有毒的盐是____________
(4)痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法。硝酸银显现法就是其中的一种:人的手上有汗渍,用手动用白纸后,手指纹就留在纸上。如果将硝酸银溶液小心涂到纸上,硝酸银就跟汗迹中的氯化钠作用,生成氯化银,其反应的化学方程式是_____________。氯化银在光照条件下分解生成银粒和氯气。银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色逐渐变成黑色,从而显现出黑色的指纹。
(5)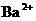 是有毒的物质,但给胃作X光造影时,用BaSO4作钡餐而不造成中毒。________(填能或不能)用BaCO3代替硫酸钡,原因是_____________。
是有毒的物质,但给胃作X光造影时,用BaSO4作钡餐而不造成中毒。________(填能或不能)用BaCO3代替硫酸钡,原因是_____________。
(6)为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NO)反应,转化为空气中含有的两种气体(其中一种为单质),该反应的化学方程式为___________________________,其中NO发生了 (填“氧化”或“还原”)反应。
(7)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为 ,为了提高水对二氧化氮的吸收率,可采取的措施为 、
18.(14分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
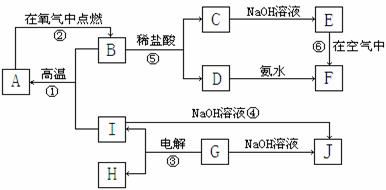
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是 。
(2)写出物质的化学式:B ;C ; G ;
(3)写出①、⑥反应的化学方程式:
反应①:
反应⑥:
(4)从能量变化的角度看,①②③反应中属于放热反应的是___________。(填序号)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com