
题目列表(包括答案和解析)
3.化学研究中,只有了解物质的结构,才能深刻地认识它们的性质和变化规律。下列关于物质结构的说法正确的是
A.失电子难的原子获得电子的能力不一定强
B.冰是由氢原子和氧原子直接构成的
C.原子及其离子的核外电子层数等于该元素所在的周期数
D.M层电子为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等
2.2005年10月,载有两名航天员的神州六号在 酒泉发射中心顺利升空并于5天后安全
返回,这表明我国的载人航天事业又取得新的突破。 推动上千吨火箭和飞船的巨大能量是
从哪里来的?火箭使用燃料是偏二甲肼[(CH3)2NNH2],火箭升空时发生的化学反应为:C2H8N2
+2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关该反应的说法正确的是
A.该反应的氧化剂是偏二甲肼 B.该反应进行时把热能转变成化学能
C.该反应中氮元素的化合价升高 D.该反应中每生成1molCO2转移8mol电子
1. 生活中碰到某些问题常常涉及到化学知识,下列叙述不正确的是
A.人的皮肤在紫外线的照射下将逐步会失去生理活性
B.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
C.血液是由血球在血浆中形成的胶体,因而肾功能衰竭的病人血液中的毒素可以通过透析的方法除去
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打溶液或氨水
20.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
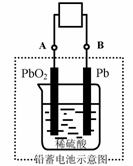 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由B到A
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H
PbO2+SO42-+4H
19.夏日夜晚常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
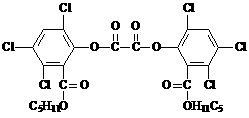
下列有关说法正确的是
A.草酸二酯属于芳香族化合物
B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
18.下列叙述正确的是
A.0.01mol/LCH3COOH与pH=12的NaOH溶液混合,若有c(CH3COO-)>c(Na+),则混合液一定呈碱性
B.常温下,将等体积0.01mol/LHCl与pH=12的氨水混合,则混合液的pH=7,
C.0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+2c(HA‑)+2c(A2-)
D.将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2
17、下列反应离子方程式正确的是
A.向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- == AlO2- + 2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O- →2C6H5OH + CO32-
C.向小苏打溶液中加入盐酸: CO32- +2H+ == CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br- + 2Cl2 == Fe3+ + Br2 + 4Cl-
16.下列各组离子,在指定的环境中一定能大量共存的是
A、在pH为7的溶液中:Ag+、K+、SO42-、Cl-
B、在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32-
C、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-、
D、在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
15.合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%.最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2--→2NH3,有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂降低了反应所需要的能量,提高了活化分子百分数
14.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)=Z(g)
D.反应开始到10 s时,Y的转化率为79.0%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com