
题目列表(包括答案和解析)
1.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同
22.(1)OH-+H+= H2O(1分) AlO2-+H++H2O=Al(OH)3 ↓(2分)
(2)70 mL (2分);150 mL(2分) (3)0.72(或72%)(3分)
21.(1)未见沉淀生成 反应后的镁条发现可被磁铁吸引 (各1分)
对反应后的溶液用激光束照射,看是否有明亮的光路即是否能产生丁达尔效应(2分)
水解和氧化还原反应在镁与饱和氯化铁是竞争反应,同时存在 (2分)
(2)Mg与FeCl3稀溶液只发生拉动水解平衡的反应,此时生成了Fe(OH)3沉淀(1分)
(3)镁与浓、稀氯化铁溶液反应的现象和机理均有所不同,说明条件对化学反应的重要性,化学研究中必须以实验事实为依据,结合理论分析,创造性地求得新知 (2分)
20.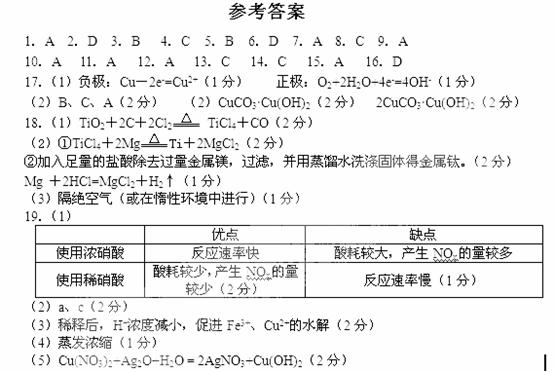 (1)
(1)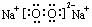 (1分) 黄色(1分) (2)Fe2O3 (1分)
(1分) 黄色(1分) (2)Fe2O3 (1分)
(3)2Al+2OH-+2H2O=2AlO2- +3H2↑(2分)
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
22.(10分)某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验。将合金3.0克投入足量的100 mL 1.5 mol•L-1烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0 mol•L-1盐酸,加入盐酸的体积与得到沉淀的数据如下表:
|
实验次数 |
加入盐酸的体积 |
沉淀质量 |
|
1 |
60
mL |
0 |
|
2 |
80
mL |
0.78g |
|
3 |
180
mL |
5.46g |
(1)从开始加入盐酸到生成最大量沉淀,溶液中发生反应的离子方程式依次为:
。
(2)开始沉淀时加入的盐酸体积必须大于 mL,若得到沉淀的量最大时,加入的盐酸体积为 mL。
(3)合金中铝的质量分数为 。
21.(9分)已知金属镁与氯化铁和氯化铜溶液反应有多种实验假设。甲、乙两位同学分别设计合理实验步骤探究该反应的历程。
提出猜想:
甲:推测镁与氯化铁、氯化铜水解产生的H+反应,拉动水解平衡生成H2。
乙:推测镁与氯化铁、氯化铜发生氧化还原反应。
结合对试剂的选择两位同学做了如下实验:
实验过程:
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
将打磨过的镁条取加入经盐酸酸化的饱和氯化铁溶液,充分反应 |
始终有大量气泡,颜色无明显变化,未见沉淀生成,反应完全后取出镁条,发现可被磁铁吸引 |
|
② |
将打磨过的镁条取加入0.1mol/L氯化铁溶液,充分反应 |
有少量气泡,颜色变浅,有红褐色沉淀生成,反应完全后取出镁条,发现不能被磁铁吸引 |
根据实验操作,实验现象,甲、乙再分别推测解释相应的结论。
(1)与甲同学的推测不尽符合的现象是 , 。
在实验①②的基础上甲进一步提出猜测:镁与H+反应拉动饱和氯化铁的水解平衡生成Fe(OH)3胶体,故未看到沉淀现象。
要验证甲的进一步猜想,还须补做的实验是 。
提出你的猜想 。
(2)乙:根据实验②可推测 。
(3)结合甲,乙两位同学的推测,你能否谈谈对上述实验事实的认识:
。
19.(10分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下:
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 。
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C加入适量水冲稀的目的是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 。
(4)步骤E进行的操作是 。
(5)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
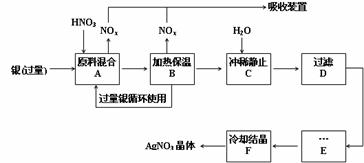
(7分)以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。

请回答下列问题:
(1)C的电子式是 ,I溶液的焰色反应呈 色。
(2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式: 。
(3)写出①反应的离子方程式: 。
(4)写出②反应的化学方程式: 。
18.(8分)钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
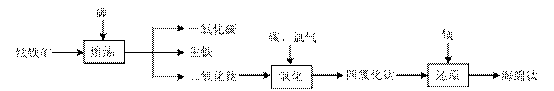
(1)氯化的过程为:将二氧化钛、炭粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式为 。
(2)还原过程为:用过量的镁在高温条件下与TiCl4反应制得海绵钛。
①写出此反应的化学方程式: 。
②简述如何从上述所得产物中获得金属钛?简述步骤并写出有关反应方程式。
(3)还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 。
17.(8分)铜器锈蚀的结果会生成铜绿(碱式碳酸铜),孔雀石和石青是自然界存在的两种碳酸盐类铜矿。
(1)在潮湿的空气中,铜与空气中的二氧化碳、水和氧气等共同作用发生吸氧腐蚀,生成碱式碳酸铜,有关反应的电极方程式为: 。
(2)某种碱式碳酸铜的组成可表示为Cu2(OH)2CO3·xH2O,在加热条件下,发生分解的化学方程式为:Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。
2CuO+CO2↑+(x+1)H2O。现取该碱式碳酸铜样品,进行测量该样品(粉末)组成中碳的质量分数和结晶水x的值的实验。
现有下面几种仪器(必要的铁架台、铁夹、酒精灯、橡皮管等,均在图中略去)
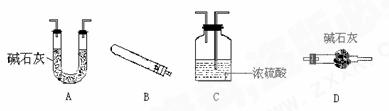
用上述仪器进行组装并做实验时,按气流方向从左到右连接顺序是(用字母填写,下同)( )→( )→( )→(D)
(3)孔雀石和石青的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)。孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4 :1;石青则为3 :1,请推算它们的化学组成。
孔雀石: ;石青: 。
16.某同学设计如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是( )
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: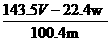 ×100%
×100%
第Ⅱ卷(非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com