
题目列表(包括答案和解析)
22.(12分)
⑴CH3+.CH3-.CH3-都是重要的有机反应中间体,有关它们的说法正确的是 ▲ 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3.H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置: ▲ 周期, ▲ 族, ▲ 区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ▲ ;葡萄糖分子中碳原子杂化方式有 ▲ 。
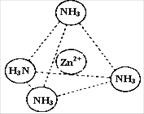
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 ▲ (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。
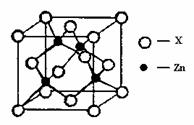
④右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ▲ ;该化合物的晶体熔点比干冰高得多,原因是 ▲ 。
江苏省江浦高级中学2010-2011学年高三年级模块练习(10月)
化学试卷 答卷纸
21.(12分)将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是_____▲_____,可能有的阳离子是____▲____.(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是____▲____,可能含有的阳离子是____▲____.
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于___▲_____.
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为___▲_____.
20.(12分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下:
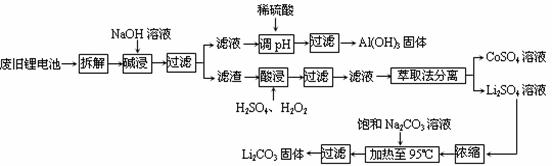
(1)上述工艺回收到的产物有 ▲ 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______▲________。
(3)碱浸时主要反应的离子方程式为__________▲___________。
(4)酸浸时反应的化学方程式为_____▲______。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是______▲_________。
(5)生成Li2CO3的化学反应方程式为______▲______。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应_______▲_____。
19、(10分)氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂。以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图。
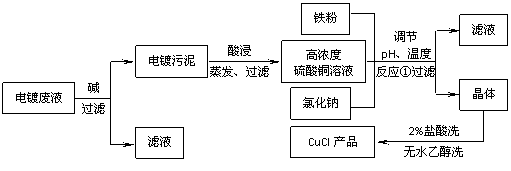
下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。

试填空。
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
▲ 。
(2)由反应①制备CuCl时的最佳pH在 ▲ 左右。
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有 ▲ 的特性。
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为: ▲ 。
如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为: ▲ 。
18.(10分)下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他为化合物.
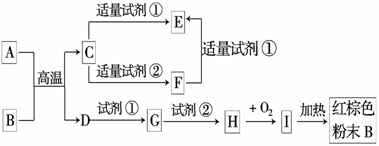
试推断:
(1)写出物质的化学式:A:______▲______.C:____▲________.I:____▲________.
(2)写出下列反应的方程式:
C→F的离子方程式______________________▲________________________.
H→I的化学方程式_______________________▲_________________________.
17.(10分)“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:
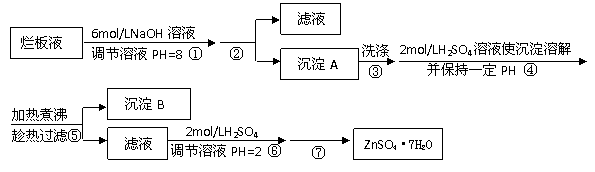
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
|
离子 |
开始沉淀时的PH |
完全沉淀时的PH |
|
Fe3+ |
1.9 |
3.2 |
|
Zn2+ |
6.4 |
8.0 |
⑴第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是 ▲ 。
⑵第②步操作中需要的玻璃仪器有 ▲ 。
⑶第④步中PH应保持在 ▲ 。
⑷第⑥步调节溶液PH=2的目的是 ▲ 。
⑸操作⑦包含3个基本实验操作,它们是 ▲ 、 ▲ 和过滤。
16.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉
变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请回答下列问题:
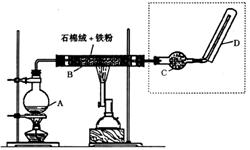
(1)B中发生反应的化学方程式为 ▲ 。
(2)反应前A中投放碎瓷片的目的是 ▲ 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 ▲ 。
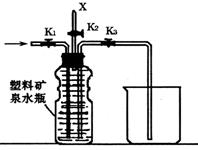
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。实验开始时,打开K1.K2,关闭K3,使反应先进行一段时间之后,必须进行 ▲ 操作,方可关闭K2.打开K3,再收集气体。当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是 ▲ 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 ▲ 。
14、向一定量的Fe.FeO.Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为 ( )
A. 68.6% B. 77.8% C. 81.4% D. 无法计算
非选择题(共78分)
13、 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O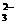 +O2+xOH-
Fe3O4+S4O
+O2+xOH-
Fe3O4+S4O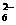 +2H2O,
+2H2O,
下列说法中,正确的是 ( )
A.每生成1 mol Fe3O4,反应转移的电子总数为4 mol
B.Fe2+和S2O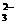 都是还原剂
都是还原剂
C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3 mol
D.x=2?
12、下列离子方程式书写正确的是 ( )
A.用氢氧化钠溶液出去铝表面的氧化膜:
B.用浓盐酸与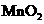 反应制取少量氯气:
反应制取少量氯气:
C.在强碱溶液中次氯酸钠与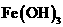 反应生成
反应生成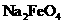 :
:
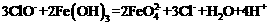
D.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com