
题目列表(包括答案和解析)
7.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.5.6 g铁与足量氯气完全反应转移的电子数为0.2NA
B.100 mL 2.0 mol·L-1的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA
D.体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA
6.下列说法中没有错误的是 ( )
A.14C16O和12C18O两个分子所含质子数、中子数和原子个数均相等
B.1H2和2H2互为同位素,它们的质子数相等
C.14C和14N的质量数相等,它们是同素异形体
D.NH4+和H3O+两个离子的电子数、质子数和中子数均相等
26.铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
25.我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。
(1)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
Ⅰ、空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_________________(写出离子方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③_________________(写出离子方程式)。
其中反应②中氧化剂是_________,还原剂是___________
Ⅱ、空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式 ____________________ 。
Ⅲ、溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的实验仪器名称是 ___________________。
下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
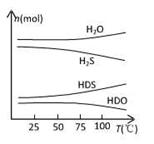 (2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
(2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个
反应中涉及的四种物质在反应体系中的物质的量随温
度的变化曲线。写出100℃时所发生的反应的化学方
程式________________________________________;
工业上富集HDO的生产过程中,可以循环利用的一种
物质是____________________。
24.已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。

请回答下列问题:
(1)X的化学式为 , F的电子式为
(2)在反应①②③④中属于置换反应的是 (填序号)。
(3)反应②的离子方程式为_______________________________________________。
(4)X溶液与F反应的总化学方程式为 。
(5)若向100 mL盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体。则滤液A中溶质的物质的量浓度为_________。(假设溶液体积不变)
23.用如下装置可以完成一系列实验(图中夹持装置已略去)。
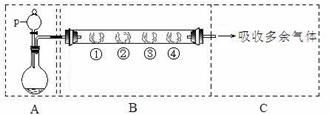
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
。
22.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
21.配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是
A.容量瓶中原有少量蒸馏水 B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视 D.滴管加水时,有少量水滴到容量瓶外
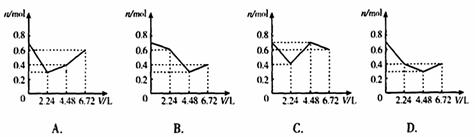
20.往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)
19.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL的NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com