
题目列表(包括答案和解析)
18.(10分) 工业纯碱中常含有少量NaCl杂质,可用下列装置测定纯碱中碳酸钠的质量分数。如图所示,从D处鼓入空气,A试管盛有NaOH溶液,E是盛有稀硫酸的分液漏斗,B广口瓶中放的是含有NaCl杂质的Na2CO3固体,C为盛有浓硫酸的试管,F、G均为盛有碱石灰的干燥管。
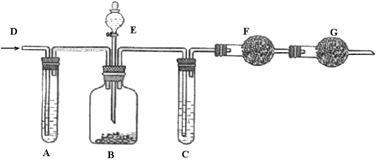
实验操作如下: ①检查装置的气密性;②在干燥管F内填满颗粒状碱石灰,其总质量为m1 g;③称取一定量的纯碱样品m2 g,并放入广口瓶中;④从分液漏斗中缓慢的滴入稀硫酸,至不再产生气体为止;⑤从D处缓慢鼓入空气数分钟,然后再称量干燥管F,其总质量为m3 g。回答下列问题:
(1) 鼓入空气的目的是_____________________________________________。
(2) 装置G的作用是_______________________________________________。
(3)装置A的作用是_______________________________________________。
(4)样品中碳酸钠的质量分数计算式为_______________________________。
(5)如撤去装置A,则将导致实验结果____。(填“偏大”、“偏小”或“不变”)
17.(10分)物质A是化合物,B、C、D、K都是单质,反应②-⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
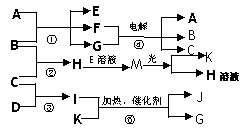
请填写下列空白:
(1)写出下列物质的化学式:B_____;D_____;K______.
(2)写出⑤反应的化学方程式:__________________________________。
(3)B、C、D形成的离子化合物水溶液显酸性的离子方程式为: ___________________
16.在某种接近中性的含Na+的无色溶液中,可能还存在NH4+、Fe3+、Br-、CO32-、I-、SO32- 6 种离子中的几种:①在原溶液中滴加足量的氯水后,有气泡产生,溶液呈橙黄色,②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,③橙黄色溶液不能使淀粉变蓝,根据实验事实判断,该溶液中肯定不存在的离子是
A. Fe3+、I-、 SO32- B. NH4+、 I-、SO32-
C. NH4+、Br-、CO32- D. Fe3+、CO32-、I-
第Ⅱ卷(非选择题,共52分)
15. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
14.将5.1 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,金属完全溶解,然后再加入4 mol/L 的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A.200 mL B.250 mL C.425 mL D.560 mL
13.下列各组物质中,不能按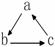 (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是
|
选项 |
A |
B |
C |
D |
|
a |
Fe |
SiO2 |
Al(OH)3 |
HNO3 |
|
b |
FeCl3 |
Na2SiO3 |
NaAlO2 |
NO |
|
c |
FeCl2 |
H2SiO3 |
Al2O3 |
NO2 |
12.在a L Al2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L) 为
A.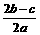 B.
B.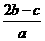 C.
C.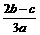 D.
D.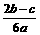
11.欲除去CO2中混有的少量氯化氢,最好采用的溶液是
A.浓硫酸 B.石灰水 C.饱和碳酸钠 D.饱和小苏打
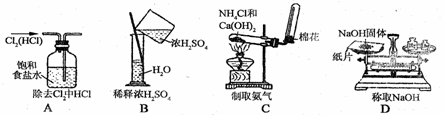
10.中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是
9.下列反应的离子方程式正确的是
A.将SO2通入Ca(ClO)2溶液中: SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
B.向氢氧化钠溶液中通入少量CO2: OH-+CO2=HCO3-
C.向Ba(OH)2溶液中逐滴滴入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH-+H++SO2-4==BaSO4↓+H2O
D.FeCl2溶液中通入Cl2: 2Fe2++Cl2==2Fe3++2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com