
题目列表(包括答案和解析)
29.(共12分)Fe是地壳中含量很丰富的元素,也是生物体所必须的元素。
⑴我国南方某些地区的井水取来久置后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”。这层“锈皮”的主要成分是(写化学式) 。
⑵家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是 ;(填序号)
A.4Fe(OH)2 + 2H2O + O2 == 4Fe(OH)3
B.2Fe + 2H2O + O2 == 2Fe(OH)2
C.2H2O + O2 + 4e- == 4OH- D.Fe – 3e- == Fe3+
⑶某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3+ + SO32- + H2O == 2Fe2+ + SO42- + 2H+;二是发生双水解反应:2Fe3+ +3SO32- +6H2O == 2Fe(OH)3(胶体) + 3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为__ ____,另一份中加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的化学方程式 。
②实验Ⅱ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ,产生的现象完全相同。由上述实验得出的结论是 。
③若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无
色气体,该反应的离子方程式是 。
28、(12分)现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
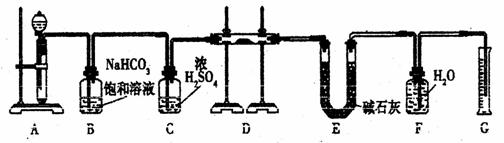
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 。
(2)装置B的作用是 __ 。
装置C的作用是 _____ 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 ______ 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
27.(9分)已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:_ _____ (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________。
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂: A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰酸钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液
|
实验方案 |
所选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离
子是___ ,相应的离子方程式为 ________________ ;
__________________________ 。
26.(10分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH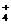 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO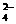 、NO
、NO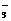 、
、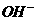 、CO
、CO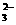 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是 __________________ 。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式 __________________
第Ⅱ卷(填空题 共52分)
25.(9分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气法提纯,其反应式为:
(1)配平下列反应的化学方程式:
____ C+ ____ KMnO4+
____ H2SO4
____CO2↑+ ____MnSO4 + ____K2SO4+
____H2O
(2)反应的氧化剂是 ,被氧化的元素名称是 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生1.12L(标准状况下)CO2气体,则转移的电子数是 。
24.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
|
考试座位号 |
成 绩 |
|
|
|
2011届高三第二次月考试卷
化 学 试 题
23.使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平称量时游码没有归零
②用量筒量取液体时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤ B.①③⑥ C.③④⑥ D.①②④
22.下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是( )
A. FeBr2与Cl2 B. Ba(OH)2与H2SO4
C. HCl与Na2CO3 D. Ca(HCO3)2与NaOH
21、下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤浓HCl在与MnO2共热制取Cl2的实验中只起到还原剂的作用
A.①②③ B.③④ C.②③ D.③⑤
20、氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应 D、生成1molN2有6mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com