
题目列表(包括答案和解析)
7. 将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分发生2 反应后,其结果是( )
A.往溶液中滴入无色的KSCN溶液,不显红色;
B.Fe2+和Fe3+的物质的量比为6:1;
C.反应中氧化产物和还原产物的物质的量比为2:1
D. 铁粉有剩余,溶液浅绿色,Cl-的浓度基本保持不变;
6、.在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质
量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有
的阳离子是 (
)
(
)
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
5.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混
和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且
用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数
约为( )
A.2.5×1019个 B.2.5×1022个
C.5×1019个 D. 5×1022个
4. 人类在探索自然和科学考察的活动中,经常要面临无氧环境,在你熟
悉的物质中,可以选用作为供氧剂的是( )
A. NaOH B. Na2O2 C. Al2O3 D. NaHCO3
3. 已知最外层电子数相等的元素原子具有相似的化学性质,如锂、钠、
钾最外层都为一个电子而性质相近。某元素原子的核外电子分层排布示
意图为 ,下列原子中,与该元素原子化学性质相似的是( )
,下列原子中,与该元素原子化学性质相似的是( )
A.  B.
B. 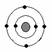 C.
C.  D.
D.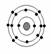
1 下列实验操作中,错误的是( )
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处
C. 用酒精萃取碘水溶液中的碘
 D.
称量时,将称量物放在称量纸或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘中
D.
称量时,将称量物放在称量纸或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘中
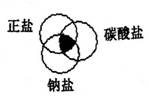
2.符合右图中阴影部分的物质是( )
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
21.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
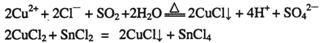
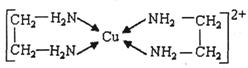 ②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为___。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为_______。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是________________________。
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
20.(10分)利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是 。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)=
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是 。与方法一相比,方法二的优点是 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
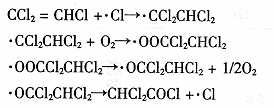
该反应的总化学方程式为 。
19.(8分)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是 。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气, 臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:

用臭氧消毒自来水,适宜的条件是 。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) = 4Ag(s)+ O2(g)△H=62.2 kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为: 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式: 。
18.(14分)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O2 2ZnO+2SO2 ;鼓风炉中:2C +O2
2ZnO+2SO2 ;鼓风炉中:2C +O2 2CO
2CO
鼓风炉中:ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对些研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
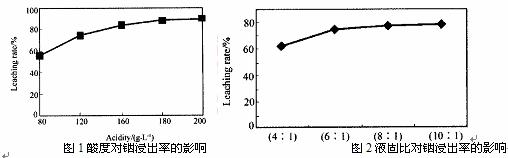
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为: 、 。
(2)湿法炼锌的主要工艺流程为:

①硫酸浸取的主要反应的离子方程式为: 。
②从保护环境和充分利用原料角度,如何处理或利用烟气 。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com