
题目列表(包括答案和解析)
|
1 ----------------------------------------------------------------------------------------------------------------
2 -----------------------------------------------------------------------------------------------------------------
3 ------------------------------------------------------------------------------------------------------------------
4 -----------------------------------------------------------------------------------------------------------------
5 --------------------------------------------------------------------------------------------------------------------
18、(8分)
|
2 --------------------------------------------------------------------------------
3 --------------------------------------------------------------------------------
4 --------------------------------------------------------------------------------
21.(10分) 已知①-④均为工业生产及应用的常见反应。其中常温下B、D、J、P气体,E为分子中原子个数比为1∶l的液体。A的相对分子质量为120。M的焰色反应为黄色。(个别反应的产物已略去)
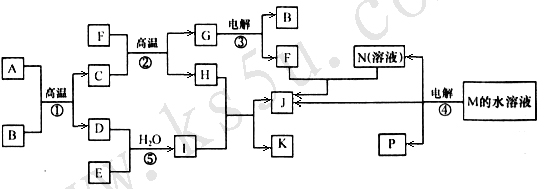
试回答下列问题:
(1) 反应F与N溶液反应的离子方程式为_____________________________________;
(2)
 反应⑤中当有1mol电子转移时,氧化剂消耗
g。
反应⑤中当有1mol电子转移时,氧化剂消耗
g。
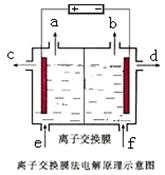
(3) 反应④的离子方程式为______________________________;
右图是该反应原理的示意图,该装置中使用的是 (填“阴”或“阳”)离子交换膜。图中从d处收集到的是 。
(4)
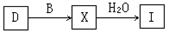 工业上由D制取I的过程可表示为:
工业上由D制取I的过程可表示为:
由D与B反应生成X的反应所用的设备是
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
已知400℃ 101Kpa时,2D(g) + B(g) 2X(g);△H = – 196.6KJ/mol,当2 mol D与1 mol B在该条件下反应达平衡时反应放热186.8
KJ。
2X(g);△H = – 196.6KJ/mol,当2 mol D与1 mol B在该条件下反应达平衡时反应放热186.8
KJ。
在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件______
①适当升高温度 ②增大压强 ③使用合适的催化剂 ④及时移走生成物 ⑤适当增大B的浓度 ⑥将反应物与生成物在热交换器中进行热交换
22(8分)将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。
(2)求理论上原硝酸的物质的量浓度。
(3)求混合气体中NO2、NO的体积比。
(4)写出上述反应的总的化学方程式。
|
17、(9分)A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族;A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子。
(1)我国普遍采取一种方法制取含有A、C、E三种元素的某重要化工产品,其工业生产的第一步反应方程式是: ;
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应。甲的一种用途是 ;由甲中的两种元素组成,且与甲等电子的物质为乙,乙与水化合的产物与C的单质在KOH溶液中形成燃料电池(惰性电极)的正极反应式为 。
(3)D 与C形成的一种化合物具有强氧化性,这种化合物中阴离子与阳离子个数比为 ;
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应离子方程式是:
;
(5)A与C能形成两种化合物,写出其中一种化合物转化为另一种化合物的化学方程式:
18 (8分) 有:KIO3、KI、KBrO3、Br2、H2SO4、K2SO4和H2O
(1)请将KIO3之外的反应物和生成物分别填入以下空格内:
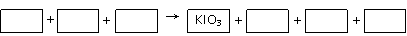
(2)其中被还原的元素是_________;氧化产物是______
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目
(4)已知在同样条件下,KIO3能和KI反应生成I2。若在酸性(硫酸)溶液中混合KI,则反应后的氧化产物为_____________。
19(6分)某久置的FeCl2溶液略显黄色,同学认为可能有部分Fe2+被氧化成Fe3+
(1)请设计实验验证溶液中是否存在Fe3+
___________________________________________________________________
(2)若溶液中存在Fe3+,应如何除去?(用离子方程式说明)
__________________________________________________________________
(3)若把溶液的Fe2+全部转化成Fe3+应该如何操作?(用离子方程式说明)
20, (共11分) 请根据下图作答:
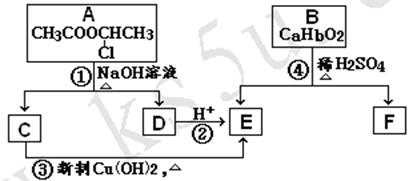
已知:一个碳原子上连有两个羟基时,易发生下列转化:
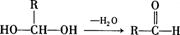
(1) 反应①所属的有机反应类型是_______________反应。
(2) 反应③的化学方程式__________________________________________________。
(3) 已知B的相对分子质量为162,其完全燃烧的产物中n(CO2)∶n (H2O) = 2∶1,则B的分子式为 。
(4) F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(5) 化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G的结构有 种。
(6)
化合物H是B的同分异构体,H分子中含有的部分结构为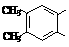 ,它的水解产物经聚合反应后可得到高聚物(CaHbO2)n.。H有多种结构,写出其中一种的结构简式
。
,它的水解产物经聚合反应后可得到高聚物(CaHbO2)n.。H有多种结构,写出其中一种的结构简式
。
16.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL.
第Ⅱ卷(共52分)
15.向体积Va的0.05mol·L-1NH3•H2O溶液中加入体积为Vb的0.05mol·L-1HCl溶液,下列关
系错误的是
A. Va>Vb时:C(NH3•H2O ) +C( NH4+)>C(Cl-)
B. Va=Vb时:C(NH3•H2O )+ C(OH-)=C(H+)
C. Va<Vb时:C( NH4+) > C(Cl-)> C(H+)>C(OH-)
D. Va与Vb任意比时:C( NH4+) + C(H+) =C (OH-)+ C(Cl-)
14.下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入溴水中 |
验证SO2具有漂白性 |
|
B |
在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
|
C |
淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾 |
检验淀粉水解产物有还原性 |
|
D |
将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 |
检验气体中含有乙烯 |
13.下列排列顺序正确的是
A. 还原性:F->Cl->Br->I- B.碱性:KOH>NaOH>Mg(OH)2>Be(OH)2
C.原子半径:Na>S>F>O D.NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-)
10、在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是 ( )
A、Mg2+、Na+、Cl-、CO32- B、Ba2+、K+、OH-、NO3-
C、H+、Al3+、NH4+、SO42- D、Na+、Ca2+、Cl-、HCO3-
11:阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.1L 1mol·L-1 CH3COOH溶液中,CH3COOH分子数约为6.02×1023
B.常温常压下,N2和O2混合气体22.4 L所含的分子数等于6.02×1023
C.标准状况下,11.2L CCl4 所含的分子数约为3.01×1023
D.含有0.01mol FeCl3的饱和FeCl3溶液滴于沸水中,继续煮沸,形成的红褐色Fe(OH)3胶体中含有的Fe(OH)3胶粒数目少于6.02×1021
12,上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共交通作为“绿色”花园中的一点鲜艳的绿色已正式启动,解决了汽车尾部冒黑烟的问题。下列叙述正确的是
A.甲醚与乙醇是同分异构体
B.甲醚可由甲醇在一定条件下发生消去反应而制得
C.甲醚作燃料不会产生氮的氧化物和碳氢化合物的污染
D.1mol甲醚完全燃烧消耗的氧气与1mol甲醇完全燃烧消耗的氧气相同。
9、下列离子方程式正确的是 ( )
A、碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O
B、氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH4+△ H2O + NH3↑
C、氢氧化镁与稀硫酸反应 H+ + OH- = H2O
D、碳酸钠溶液与盐酸反应Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
8.为了配制100mL1mol·L-1NaOH溶液,其中有下列几个操作:
①NaOH用纸盛载进行称量
②选刚用蒸馏水洗净的100mL容量瓶进行配制
③NaOH在烧瓶里刚好完全溶解,未冷却即把溶液转移入容量瓶
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相
切
其中操作错误的是( )
A. ①②③ B. ③④⑤
C. ②③⑤ D. ①③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com