
题目列表(包括答案和解析)
18、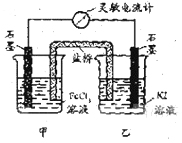 控制适合的条件,将反应
控制适合的条件,将反应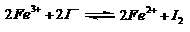 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
A、反应开始时,乙中石墨电极上发生氧化反应
B、反应开始时,甲中石墨电极上Fe3+被还原
C、电流计读数为零时,反应达到化学平衡状态
D、电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
17.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
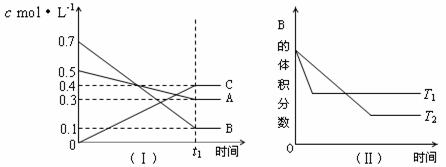
A、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B、(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C、T℃时,在相同容器中,若由0.3mol·L-1 A,0.1 mol·L-1 B,和0.4 mol·L-1 C反应,达到平衡后C的浓度仍为0.4 mol·L-1
D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
16、某溶液中含有两种溶质--氯化钠和硫酸,它们的物质的量之比为3:1。用石墨做电极电解溶液时,根据反应产物,电解可明显分为三个阶段,则下列叙述中不正确的是
A、阴极只析出氢气 B、阳极先析出氯气后析出氧气
C、电解最后阶段为电解水 D、电解过程中溶液的pH值不断增大,最后pH值为7
15、在其它条件一定时,图中曲线表示反应2NO(g) + O2(g) 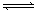 2NO2(g)(吸热反应)达平衡时
2NO2(g)(吸热反应)达平衡时
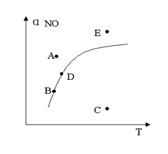 NO的转化率与温度的关系,图上标有A、B、C、D、E点,
NO的转化率与温度的关系,图上标有A、B、C、D、E点,
其中表示未达平衡状态且V正>V逆的点是
A、A或E
B、B点
C、C点
D、D点
14、下列各装置中都盛有0.1 mol·L-1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是( )
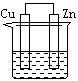
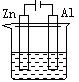


① ② ③ ④
A、③①④② B、①②④③ C、①②③④ D、②①④③
13、氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是
①负极反应为4OH--4e=O2↑+2H2O ②负极反应H2+2OH--2e=2H2O
③工作时正极区PH升高,负极区PH降低 ④工作时溶液中阴离子移向正极
A、③④ B、②③ C、②④ D、①④
12、已知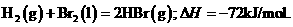 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为
A、404 B、260 C、230 D、200
11、下列关于热化学反应的描述中正确的是
A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
C、需要加热才能发生的反应一定是吸热反应
D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
10、把锌片和铁片放在盛有食盐水和酚酞溶液的表面皿中,
如图所示,最先观察到酚酞变红的区域是
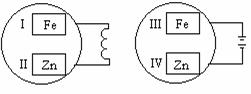 A、I和III
A、I和III
B、I和IV
C、II和III
D、II和IV
9、已知298K时,2SO2(g)+O2(g)  2SO3(g);△H = -197kJ/mol。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2 和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
2SO3(g);△H = -197kJ/mol。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2 、0.5molO2 和1molSO3 ,达到平衡时放出热量为Q2。则下列关系正确的是
A、Q2<Q1< 197kJ B、Q2=Q1=197kJ C、Q1<Q2<197kJ D、Q1=Q2<197kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com