
题目列表(包括答案和解析)
19.(12分)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
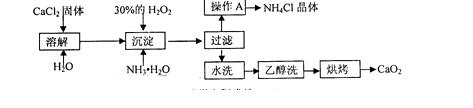
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)操作A的步骤为 ;
(3)检验“水洗”已经洗净的方法是 ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ;
②产品中CaO2的质量分数为 (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) 。
18.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是
A.J和氢组成的化合物分子中只含有极性共价键
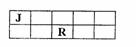 B.工业上用电解M和T组成的化合物来制备M
B.工业上用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
非选择题
17.下列说法正确的是 ( )
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2( H>O、
H>O、 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
16.人工合成的一种甜味剂的结构简式如右图所示下列说法正确的是 ( )
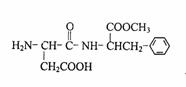 A.分子式是C14H19N2O5
A.分子式是C14H19N2O5
B.该物质分子中含有2个手性碳原子
C.该物质能发生取代、加成、缩聚反应
D.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH
15.常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,
所得滴定曲线如右图所示。下列说法正确的是 ( )
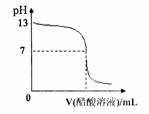 A.pH=7时,所加醋酸溶液的体积为10mL
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
14. 亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
13.用Na2SO3还原MnO4-,如果还原含有2.4×10-3molMnO4-的溶液时,消耗30mL0.2mol/LNa2SO3溶液,则Mn元素在还原产物中的化合价是( )
A、+1 B、+2 C、+4 D、+5
12.根据下列实验事实,判断微粒氧化性大小顺序正确的是 ①FeC13:溶液中滴入 KI溶液,加 CCl4振荡, CCl4层呈紫色 ②FeCl2溶液中滴加氨水,再加 KSCN溶液,呈红色 ③KMnO4溶液中滴加盐酸, KMnO4溶液的紫色褪去 A.I2<C12<Fe³+< MnO4¯ B. C12>I2> Fe³+> MnO4¯ C. MnO4¯> C12> Fe³+>I2
D. Fe³+> MnO4¯> C12>I2
11.下表中的实验操作能达至实验目的或得出相应结论的是 ( )
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加0.01mol·L-1NaCl溶液,至不再有沉淀生成,再向其中滴加 0.01mol·L-1Nal溶液,产生黄色沉淀。 |
常温下,Ksp(AgCl)>Ksp(Agl) |
|
B |
C2H5Br与NaOH溶液混合充分振荡,再加入AgNO3溶液 |
检验C2H5Br中的溴元素 |
|
C |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
|
D |
将少量某物质滴加到新制的氢氧化铜悬浊液中,加热后有红色沉淀生成 |
说明该物质一定是醛 |
10.除去下列括号内杂质的试剂或方法错误的是
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com