
题目列表(包括答案和解析)
2、据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是
A.O4的摩尔质量是64 g B.O4与O2互为同位素
C.相同质量的O4与O3所含原子个数之比为1∶1
D.O4与O3、O2都是氧元素的同分异构体
1、下列叙述中,正确的是( )
A.太阳能、核能和天然气都属于新型能源
B.哥本哈根气候大会讨论的减排目标主要是控制二氧化硫排放
C.84消毒液具有强氧化性,可杀死流感病毒
D.济南奥体中心比赛场馆“东荷”、“西柳”所用的材料都是新型无机非金属材料
27.(9分)(2)氧气(或O2)
(3)Ⅰ:Na2O2过量(或CO2不足),瓶中CO2少O2多,Na2O2部分发生反应

26.(10分)(1) 500mL容量瓶、烧杯、胶头滴管 ;
(2) 10.0 g。(3) CDF
(4) 宣告实验失败,重新配制
(5)偏小。
(6)① 搅拌 ② 引流
(7) 0.05NA 或 3.01*1022 。
25. (8分)(1) Fe , 四 周期, Ⅷ 族。
(2)C FeCl2 ,H Al2O3 。
|
(3)反应①: 2 Al +Fe2O3 2 Fe +Al2O3 。
反应⑦: 2Al+2NaOH+2H2O==2NaAlO2+3H2 ↑
(4) 白色沉淀迅速变成灰绿色,最后变成红褐色。
24.(5分)⑴FeSO4; 防止亚铁离子被氧化 ;
⑵﹤;
⑶ Al(OH)3+H+==Al3++3H2O;可以
28.(8分)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 ,其物质的量之比为 。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
Al(OH)3+OH- == AlO2-+2H2O
不能,因为在Al3+与氨水反应生成Al(OH)3后, Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(2)Cl-、K+、AlO2-、H+、OH-、Na+ 需要控制溶液的pH;以防止AlO2-部分转化成Al3+ 在溶液a中通入过量二氧化碳气体
(3)在HCl气氛中加热AlCl3溶液,使水蒸发以得到AlCl3晶体
27. (9)探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,该班同学进行了以下两个实验:
(9)探究式课堂教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,该班同学进行了以下两个实验:
(1)提出问题实验一的CO2能灭火,实验二的CO2为何能“点火”?
(2)假设与猜想
①Na2O2与CO2发生了反应,可能有Na2CO3生成;
②棉花燃烧,说明该反应放热,使温度达到了棉花的着火点;
③剧烈燃烧,反应中可能有 生成。
(3)设计并进行实验,观察、解释和结论
请你帮助他们完成下表:
|
实验步骤 |
实验现象 |
原因和结论 |
||
|
Ⅰ |
用小矿泉水瓶收集满CO2,再向瓶中加入不同量浅黄色的Na2O2;振荡后将燃着的木条伸向瓶中 |
第①小组放入少量的Na2O2 |
木条未复燃,固体由浅黄色全部变为白色 |
CO2过量(或Na2O2不足),瓶中O2少CO2多,Na2O2全部发生了反应 |
|
第②小组放入的Na2O2稍多一些 |
木条复燃,部分固体变为白色 |
|
||
|
Ⅱ |
两小组均用手触摸瓶的底部 |
瓶底发热 |
|
|
|
Ⅲ |
两小组都各取少量白色固体于试管中,滴入稀盐酸并塞上带导管的橡胶塞,将产生的气体通入 |
|
|
(4)类比推理
Na2O2与H2O反应后应该有NaOH和O2生成。则向包有Na2O2的棉花上滴两滴水,棉花也应剧烈燃烧;向生成的溶液中滴入酚酞应该变红色。
(5)实验与解释
①向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴两滴水,发现有气泡产生,杯底发热,但棉花没有燃烧,其原因可能是 ;
②向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是 。
(6)联想与启示
根据上述实验及分析,请为Na2O2的说明书写保存注意事项:
26.(10分)进行某实验需要0.5 mol/L的氢氧化钠镕液约400mL,根据溶液配制的过程,回答下列问题:
(1)实验除了需要托盘天平(带砝码)、药匙和玻璃棒外,还需要的其他玻璃仪器是 ;
(2)根据计算得知,所需要氢氧化钠固体的质量是 g。
(3)配制溶液的过程中,以下操作正确的是 (填序号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体中,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠固体的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
D.容量瓶未经干燥就使用
E.摇匀后发现液面低于刻度线,用胶头滴管补加蒸馏水至刻度线。
F.加水到液面接近刻度线1-2 cm 处,改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切
(4)若实验中,转移时发现溶液洒出,你的措施为:
(5)若没有进行C的操作,对所配溶液浓度有何影响?_________(填“偏大”、“偏小”或“无影响”)。
(6)玻璃棒在该实验中的作用有: ① ②
(7)取0.5 mol/L的NaOH溶液100 mL,所含的Na+的数目为 。
25.(8分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
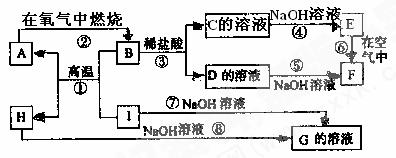
请填写下列空白:
(1)A、B、C、D、E、F六种物质中含有同一种元素为(元素符号) ,在元素周期表中位置 周期, 族。
(2)写出C、H物质的化学式:C ,H 。
(3)写出反应①、⑦的化学方程式:
反应①: 。
反应⑦: 。
(4)反应⑥过程中的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com