
题目列表(包括答案和解析)
25.1100℃时,在恒容密闭容器中,发生可逆反应:
Na2SO4(s)+4H2(g)
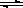 Na2S(s)+4H2O(g) 并达到平衡,请完成下列各题:
Na2S(s)+4H2O(g) 并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K= 。
降低温度,K值减小,则正反应为 (填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?(填“正向移动”、“逆向移动”或“不发生移动”)
①加入少量Na2SO4,则平衡: ②通入少量H2S气体,则平衡:
(3)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则达平衡时该容器内固体的总质量是 。
(4)若将平衡体系温度降低100℃,下述图象中能正确反映平衡移动过程中容器内变化情况的是 。
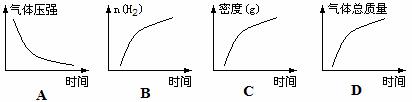
24.下表是元素周期表的一部分。
 ⑴表中元素⑨的氢化物的化学式为 ,此氢化物的稳定性比元素⑩的氢化物的稳定性 (填强或弱)。
⑴表中元素⑨的氢化物的化学式为 ,此氢化物的稳定性比元素⑩的氢化物的稳定性 (填强或弱)。
⑵可形成化合物种类最多的元素是 (填元素符号);某元素原子的核外p电子数与s电子数相等,则该元素可能是 (填元素符号)。
⑶化合物Q中仅含有元素①⑤⑥,且原子个数比为4∶2∶3,则Q的化学式为:
,其水溶液在常温下pH值 7(填“>”、“<”或“=”)。
⑷元素①与元素⑥形成的两种化合物的电子式分别是 、
⑸元素④在与元素⑨形成的化合物R中化合价呈最高价,则R的化学式为: ,R为 分子(填“极性”或“非极性”)。
⑹已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物分别与盐酸及NaOH溶液反应的离子方程式: , 。
23.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,已知水是生成物之一。
(1)写出该反应的化学方程式,并标出电子转移的方向和数目。
(2)该反应中,被氧化的元素是 ,还原产物是 。
(3)反应中1mol氧化剂得到 mol电子。
(4)若反应过程中转移0.3mol电子,则为使生成的有毒气体不逸出,可通入标准状况下的氧气 L。
22.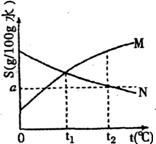 如图是M、N两种物质的溶解度曲线,在t2℃时往盛有l00g水的烧杯中先后加入a gM和a gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是 AD
如图是M、N两种物质的溶解度曲线,在t2℃时往盛有l00g水的烧杯中先后加入a gM和a gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是 AD
A.t2℃时,得到N的饱和溶液、M的不饱和溶液
B.温度降到t1时,M、N的溶解度相等,得到M、N的饱和溶液
C.温度降到t1时,M、N的物质的量浓度相等,得到M、N的不饱和溶液
D.温度降到t1时,M、N的溶质质量分数相等,得到M、N的不饱和溶液
21.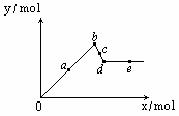 已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述不正确的是C
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述不正确的是C
A.a-b时沉淀的物质的量:BaSO4比A1(OH)3多
B.c-d时溶液中离子的物质的量:
AlO2-比Ba2+多
C.a-d时沉淀的物质的量:
BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
20.下列各种微粒浓度间的关系式中,正确的是( )AC
A.常温下,若氨水和(NH4)2SO4混合溶液的pH=7,则[NH4+]∶[SO42-]=2∶1
B.在Na2CO3溶液中,[H+]+[Na+] = [CO32-]+ [HCO3-]+ [OH-]
C.在NH4HCO3溶液中,[NH4+]+[NH3·H2O]+ [NH3]=[HCO3-]+[CO32-]+[H2CO3]
D.在Na2S溶液中,2[Na+] = [H+]+ [HS-]+ [H2S]
19、下列说法正确的是A
A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量 MnO2,研究催化剂对H2O2分解速率的影响
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
18、下列化学反应中只产生一种气体的是 BC
A.工业电石投入食盐水中 B.表面有氧化膜的铝条插入到烧碱溶液中
C.镁条插入到甲酸溶液中 D.炭块投入热的浓硝酸中
17.室温时容积为m mL的试管内充满NO2气体,倒置在水中至水面不再上升为止,再通入n mLO2,则管内液面又继续上升,测得试管内最后剩余气体a mL,且该气体不能支持燃烧,则m、n的关系是 C
A.m:n= 4:1 B.m:n= 4:3 C.m= 4n+3a D.m= 4n+a
16.如图是电解饱和食盐水的装置,下列有关判断正确的是 B
A.电解时阳极得到氯气,阴极得到金属钠
B.若在阳极附近的溶液中,滴入KI溶液,溶液显棕黄色
C.若在阴极附近的溶液中滴入酚酞试液,溶液不变色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com