
题目列表(包括答案和解析)
14、对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是
A.Br – B.SO42– C.H2SO3 D.NH4+
13、 一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
12、下列离子方程式书写正确的是
①.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O
②.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O
③.向次氯酸钙溶液中通入过量的二氧化硫 Ca2+ + 2ClO – + SO2 + H2O = CaSO3↓+ 2HClO
④.已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠PH逐渐减小,向次氯酸钠溶液通少量二氧化碳 ClO- +CO2 +H2O = HClO + CO32-
⑤.过氧化钠固体与水反应:2O22‾+2H2O=4OH‾+O2↑
⑥.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32‾ +H2O
⑦.澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH‾+HCO3‾=CaCO3↓+H2O
⑧.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:
2Al3++7OH‾=Al(OH)3↓+AlO2‾+2H2O
⑨、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
A ①③⑥⑨ B②④⑤⑨ C③④⑦⑧ D①⑧⑨
11、某无色透明溶液能与铝粉反应放出H2,则此溶液中一定能大量共存的离子组为
A.OH-、Na+、K+、MnO4- B.H+、Cl-、Ba2+、NO3-
C.K+、Cl-、Na+、SO42- D.NH4+、Mg2+、Cl-、HCO3-
10、实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
9、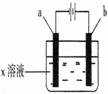 如右图所示,下列实验现象的描述正确的是
如右图所示,下列实验现象的描述正确的是
|
|
a电极 |
b电极 |
x溶液 |
实 验 现 象 |
|
A |
石墨 |
石墨 |
CuCl2 |
a极质量增加,b极放出无色气体 |
|
B |
Fe |
石墨 |
KNO3 |
a极质量增加,b极放出无色气体 |
|
C |
Fe |
Cu |
CuSO4 |
a极质量增加,b极质量减少 |
|
D |
石墨 |
石墨 |
HCl |
a极放出无色气体,b极放出无色气体 |
8.设 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P-P键数为 ②. 1mol
②. 1mol (碳正离子)中含有电子数为10
(碳正离子)中含有电子数为10 ③. 1mol铜与足量硫蒸气反应,转移电子数为2
③. 1mol铜与足量硫蒸气反应,转移电子数为2 ④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2 个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g
个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03 ⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA ⑨.28 g
C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA ⑨.28 g
C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
7.下列各溶液中,各粒子的物质的量浓度关系正确的是
A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-)
B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+)
D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S)
6、三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂 B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子 D.NF3在潮湿的空气中泄漏会产生红棕色气体
5、已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是
A.氧化产物为Cl2 B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com