
题目列表(包括答案和解析)
3.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
2.下列说法中正确的是 ( )
A.非金属氧化物一定能与碱发生反应 B.金属氧化物一定不能与碱发生反应
C.酸性氧化物一定能与水反应生成酸 D.酸性氧化物可能与酸发生反应
1.将下列各组物质按酸、碱、盐顺序排列,正确的是: ( )
A.硫酸、纯碱、石灰石 B.醋酸、酒精、醋酸钠
C.亚硫酸、熟石灰、小苏打 D.石炭酸、熟石灰、漂白粉
26. (每空3分,共9分)测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止 ⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是_____________。
(2)实验步骤⑥的目的是 。
(3)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):_____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
25. (每空2分,共8分) A、B、C、D为常见气态单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请回答:
(1)C和D反应生成的化合物的化学键类型是 。
(2)上述②中生成化合物的热稳定性强弱为__________________(填写化学式)。
(3)将D通入B、C生成的化合物中,发生反应的化学方程式是:_______________________________。
(4)A、C、D所含元素可组成一种离子化合物,该化合物发生水解反应的离子方程式是_____________________________________。
24. (每空2分,共8分) 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
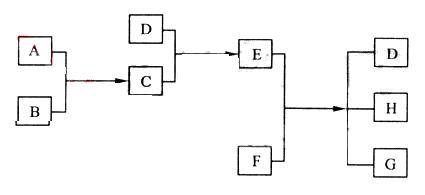
(1)D的化学式(分子式)是 ,E的化学式(分子式)是
(2)A和B反应生成C的化学方程式是
(3)E和F反应生成D、H和G的化学方程式是
23. (每空2分,共10分) 以下一些氧化物和单质之间可发生如图所示的反应: 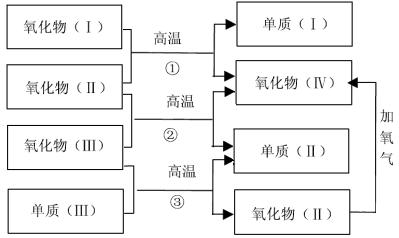
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。
氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是
。
反应②的化学方程式是 。
反应③的化学方程式是 。
22. (每空1分,共9分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是__________、B元素是__________、C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是__________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是__________,电子式是__________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是__________。
21、(每空2分,共16分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___________________________。
(3)X的硝酸盐水溶液显____________性,用离子方程式解释原因:____________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________。
(5)比较Y、Z气态氢化物的稳定性:________________________。(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_______________________。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:_____________________________。
20. 若1 mol 某气态烃CxHy完全燃烧,需用3 mol O2,则:
A.x=2,y=2
B.x=2,y=4
C.x=3,y=6
D.x=3,y=8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com