
题目列表(包括答案和解析)
8.某气体可能含有N2、HCl、CO中的一种或几种,将其依次通入足量NaHCO3溶液和灼热CuO,气体的体积都没有变化,再通过足量的碱石灰,气体体积减小,但还有剩余气体,以下对该气体组分判断正确的是 ( )
A.一定没有N2,CO和HCl至少有1种
B.一定有N2,HCl和CO
C.一定有N2,CO和HCl至少有1种
D.一定有N2和CO,没有HCl
7.下列各组溶液,不用其他试剂,就可将它们区别开的是( )
A.盐酸 氢氧化钠 碳酸钠 硫酸铜
B.盐酸 硝酸银 氯化钠 硝酸钠
C.氢氧化钠 硫酸镁 碳酸钠 硫酸氢钠
D.氯化钡 硫酸钠 氯化钙 硝酸钙
6.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
|
选项 |
待提纯的物质 |
选用的试剂 |
操作方法 |
|
A |
NaCl(Na2CO3) |
盐酸 |
- |
|
B |
CO2(CO) |
O2 |
点燃 |
|
C |
Fe (Zn) |
稀硫酸 |
过滤 |
|
D |
CO2(HCl) |
NaOH溶液 |
洗气 |
5.用98%的浓硫酸(密度为1.84g·cm-3)配制1mol·L-1的稀硫酸100 mL,现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是( )
A.②⑥③⑦⑤⑥ B.②③⑦⑤⑥
C.①③⑤⑦④⑥ D.④⑦③⑤⑥
4.0.5LAlCl3溶液中含Cl-9.03×1023个,则溶液物质的量浓度是 ( )
A.0.1mol/L B.1mol/L C.3mol/L D.1.5mol/L
3.下列溶液与20mL 1 mol·L-1 NaNO3溶液中NO3-物质的量浓度相等的是 ( )
A.10 mL 1 mol·L-1 Mg(NO3)2溶液
B.5 mL 0.8 mol·L-1 Al(NO3)3溶液
C.10 mL 2 mol·L-1 AgNO3溶液
D.10 mL 0.5 mol·L-1 Cu(NO3)2溶液
2.下列实验中用错试剂的是( )
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精萃取碘水中的碘
C.用稀盐酸洗去残留在试管壁上的铜
D.用碱石灰吸收氨气中的水蒸气
1.在容量瓶上无需有的标记是 ( )
A.刻度线 B.温度 C.浓度 D.规格(容量)
2.配制一定物质的量浓度的溶液
主要仪器:容量瓶、烧杯、玻棒、胶头滴管、量筒、托盘天平及砝码、药匙
操作步骤:计算-称量-溶解-移液-定容
②容量瓶在使用前需检查是否漏水。
③称量NaOH等易潮解或有腐蚀性的固体必须在干燥洁净的小烧杯中进行且要快速称量。
④溶解或稀释过程有明显温度变化的,需等溶液温度恢复至室温才能转移到容量瓶中。
⑤往容量瓶中转移溶液时,需要用玻璃棒引流;烧杯及玻璃棒应用蒸馏水洗涤2-3次,洗涤液也要注入容量瓶中。
⑥定容时,当液面接近瓶颈刻度线1-2cm处,应改用胶头滴管滴加。
例题解析
例1.下列实验操作错误的是___________
A.测定溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与标准比色卡进行比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.配制一定物质的量浓度的硫酸溶液时,先往容量瓶中加水,然后按计算结果将一定体积浓硫酸沿玻璃棒慢慢倒入容量瓶,最后加水至刻度,摇匀。
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
[解析]该题考察的是一些化学实验的基本操作。用pH试纸测定溶液pH值时,不能预先用水润湿,否则会引起待测液浓度减小,pH值改变;容量瓶使用之前必须要检查是否漏水,方法为:在容量瓶中注入适量水,塞上瓶塞,食指顶住瓶塞,另一只手托住瓶底,倒立过来,观察是否漏水,若不漏水,将瓶正立并将瓶塞旋转180°后,再次检验;容量瓶只能用于配制溶液,不能在其中直接溶解或稀释;焰色反应的关键是用于蘸取待测物的铂丝必须洁净,所以每次检测前后需蘸取盐酸清洗,清洗后放在火焰上灼烧,直至与原来火焰焰色相同为止,再蘸取待测物进行检验,以排除杂质的干扰。答案为A、B、C、D。
例2.某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4· 10H2O),可选择的操作有(1)加适量H2SO4溶液;(2)加金属钠;(3)结晶;(4)加过量NaOH溶液;(5)加强热脱结晶水;(6)过滤。正确的操作步骤是 ( )
A.(2)(6)(3) B.(4)(6)(1)(3)
C.(4)(6)(3)(5) D.(2)(6)(1)(3)(5)
[解析]在日常生活和工业生产中需要分离许多物质,要用到化学反应。选择化学试剂时注意(1)不引入新的杂质;(2)所加试剂一般过量,以保证将杂质全部除去,同时后续试剂须将过量的前一试剂除去;(3)过程简便、安全;(4)若存在多种杂质,注意所加除杂试剂顺序。根据题目要求,主要是除去Fe3+,加过量的NaOH溶液将Fe3+沉淀。将沉淀过滤后,过量的NaOH溶液用适量的H2SO4溶液除去。再结晶得Na2SO4·10H2O,即芒硝。A、D选项用金属钠与水反应,实验不经济、不安全,且A未考虑加入过量试剂的问题,C中最后一步加强热脱去结晶水,得不到芒硝,只能得到Na2SO4固体。选B。
例3.配制100mL、1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
A.容量瓶使用前经蒸馏水清洗后没有干燥
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.俯视确定凹液面与刻度线相切
D.用敞口容器称量NaOH且时间过长
[解析] 除了称量和试剂因素外,以下操作将引起误差:
(1) 不洗涤烧杯、玻璃棒,造成所配制的溶液浓度偏低。(2) 在烧杯中溶解固体或稀释浓溶液时,不放置至室温,而趁热转入容量瓶进行定容,所得溶液的浓度偏高。(3)定容后上下倒置摇匀,发现液面低于刻度线时,再加水至刻度线,则所配制溶液的浓度偏低。(4) 定容时加水超出刻度线,又用滴管把多余的溶液取去,此时所得溶液浓度偏低。(5) 定容时俯视,所配溶液浓度偏高;定容时仰视,配制溶液浓度偏低。(6) 在溶解、转移和洗涤过程中,把溶液溅到容器外,则所配制的溶液浓度偏低。
题中A项,容量瓶配制溶液最后须加蒸馏水定容,无需干燥,只要洁净即可,故不会对配制溶液的浓度产生影响;B项操作造成溶质未全部转移至容量瓶中,所配溶液浓度减小;C项,俯视定容,所加蒸馏水的量不足,溶剂量减少,浓度偏高;D项,称量过程中,NaOH固体已经部分吸收H2O及CO2,溶质减少,浓度偏低。选C。
小实验
层析法分离--纸层析法
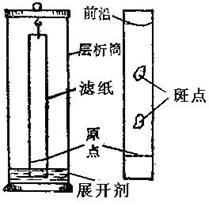 层析是利用混和物中各组分在固定相和流动相中的溶解度不同而达到分离目的,常用滤纸作载体,称为纸层析法。以纸上所吸附的水作固定相,用与水不相混溶或相混溶的溶剂作展开剂,是流动相,所用展开剂应对被分离物质有一定溶解度,通常为含一定比例水的有机溶剂。当流动相沿纸条移动时,带动着试样中的各组分以不同的速率向前移动,在一定时间内,不同组分被带到纸上的不同部位,出现层析现象,以达到分离的目的。
层析是利用混和物中各组分在固定相和流动相中的溶解度不同而达到分离目的,常用滤纸作载体,称为纸层析法。以纸上所吸附的水作固定相,用与水不相混溶或相混溶的溶剂作展开剂,是流动相,所用展开剂应对被分离物质有一定溶解度,通常为含一定比例水的有机溶剂。当流动相沿纸条移动时,带动着试样中的各组分以不同的速率向前移动,在一定时间内,不同组分被带到纸上的不同部位,出现层析现象,以达到分离的目的。
(A)将6份水、3份酒精和1份氨水制成混合溶剂。在一支大试管中倒入适量溶剂,剪一条2 cm宽的长条滤纸,从试管口悬吊下去,使其底部恰好能够浸入溶剂,且纸边不要贴在试管壁上。用铅笔在液面以上的滤纸处画一道线,点一滴红、蓝墨水的等量混合液(如图),将滤纸条放入大试管中,塞上塞子,以防溶剂挥发。溶剂由于毛细作用爬上纸条,墨水中的各种成分随溶剂扩展逐渐分开,形成不同的色带,红色带在上,蓝色带在下。可用其他溶剂和其他墨水进行实验,将各种色素很好地分开。
(B)收集各种绿叶,撕碎,放在研钵中,加入适量酒精,研磨,直到溶液呈深绿色。用毛细玻璃管在滤纸的一端点一滴绿色溶液,晾干,再在同一点上点一滴绿液制成一个小的浓缩点。将滤纸条悬挂在大试管中,使有浓缩点的一端浸入溶剂中,且浓缩点位于液面以上。色层显示是:叶黄素的橙色带在上,叶绿素的绿色带在下。若用其它适当溶剂,可使叶红素(胡萝卜素)的色层在二者之间显现出来。
习题精练
1. 物质的量浓度、溶液体积、溶质的物质的量相互关系
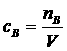 ,
, 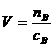 ,
, 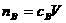
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com