
题目列表(包括答案和解析)
5.下列有关物质分类或归类正确的一组是 ( )
① 液氨、液氯、干冰、碘化银均为化合物 ② 氢氟酸、盐酸、水玻璃、氨水均为混合物 ③ 明矾、小苏打、醋酸、次氯酸均为电解质 ④ 碘酒、牛奶、豆浆、漂粉精均为胶体 ⑤ Na2O2 、Na2CO3、Na2SiO3均为钠盐
A. ①和② B. ②和③ C. ③和④ D. ②③⑤
4、设NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
A.标准状况下,80gSO3所占的体积约为22.4L
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.电解精炼铜时,当转移了2 mol电子时,阳极上溶解的铜原子数一定为NA
D.标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5 NA
3.随着科学技术的不断进步,研究物质的手段和途径越来越多,N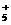 、H3、O4、C60等已被发现。下列有关说法中,正确的是
( )
、H3、O4、C60等已被发现。下列有关说法中,正确的是
( )
A. N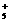 中含有36个电子
B. O2和O4属于同位素
中含有36个电子
B. O2和O4属于同位素
C. C60晶体是原子晶体 D. H2和H3属于同素异形体
2.下列化学用语或模型图表示正确的是 ( )
A.甲烷的球棍模型: 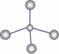 B.S2-的结构示意图为:
B.S2-的结构示意图为:
C.乙炔的最简式 CH≡CH
D.羟基的电子式 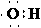
1、人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是 ( )
A、太阳能电池可将太阳能直接转化为电能
B、发展太阳能经济有助于减缓温室效应
C、煤、石油和天然气都属于碳素燃料
D、对“从菠菜叶中分离出蛋白质并制成电池”的研究仍属于碳素燃料文明范畴
22. (共14分)
Ⅰ(1)2MnO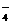 +16H++10Cl-
+16H++10Cl- 2Mn2++5Cl2↑+8H2O;(2分;无气体符号↑扣一分) 1∶5; (2分)
2Mn2++5Cl2↑+8H2O;(2分;无气体符号↑扣一分) 1∶5; (2分)

 20.(共10分)
20.(共10分)
(1)三角锥形, 银氨溶液(各1分共3分)

(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分;无△扣一分,无气体符号↑扣一分;两项都没有扣1分;所有方程式没有配平均不得分)
(3)3Cl2+8NH3=N2+6NH4Cl,(2分;NH4Cl 写成HCl不得分)3:2 (1分)
(4)Ag(NH3)2++ OH-+3H++Cl-=2NH4++AgCl↓+H2O (2分;没有沉淀符号↓扣1分)
21.(共13分)
(1)Ag+、Mg2+;(1分;多答或少答均不得分)
(2)CO32- 、Al 3+、OH-、Na+,Cl- 和SO42- 至少存在一种(3分,仅答CO32- 、Al 3+、OH-、Na+给1分;但若少其中的一种即为0分。答CO32- 、Al 3+、OH-、Na+和Cl- 和SO42-其中一种离子或两种可给2分); Ba2+ 、 SO32- ;(1分)
(3)Na2 CO3、Na OH、Al Cl 3(或Na2 CO3、Na OH、Al 2(SO4)3等);(2分;出现难溶物不给分、少一种或多一种不得分)
(4)(6分,只检验一种离子且正确得3分;没有强调离子检验的先后但方法都正确又没有加入离子干扰则得6分;分两次,分别检验方法正确也可得6分;只检验一种离子方法错误则不得分)
|
待检验的离子 |
检验方法 |
|
先检验SO42-(1分) |
取(1)中溶液用硝酸酸化后滴加Ba(NO3)2[BaCl2、Ba(OH)2也可]溶液观察是否有白色沉淀生成。(2分) |
|
再检验 Cl-(1分) |
若上述实验无沉淀,则继续加入AgNO3溶液观察是否有白色沉淀生成;若有沉淀,则至沉淀完全后取上层清液(或过滤后取滤液)滴加AgNO3溶液观察是否有白色沉淀生成(若上步用Ba(OH)2则要硝酸酸化,否则不得该2分;上问用盐酸酸化或上问加入的是BaCl2则本问不得2分)。(2分) |
第Ⅱ卷(非选择题 共56分)
23.(共12分)实验室中有甲﹑乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲﹑乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,共收集到CO2气体224mL﹙标况﹚。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,共收集到CO2气体112mL﹙标况﹚。 请回答:
(1)根据上述两种不同操作过程及实验数据可判断甲溶液是 (填名称) (2)甲溶液的物质的量浓度为 mol﹒L-1
乙溶液的物质的量浓度为 mol﹒L-1 ﹙忽略CO2在溶液中的少量溶解﹚。
(3)若用类似上述“互滴”的方式。
①将100 mL 3mol/L的NaAlO2溶液逐滴加到50mL12mol/L的HCl溶液中,充分反应。
写出发生反应的总反应离子方程式 。
②将50mL12mol/L的HCl溶液逐滴加入100 mL 3mol/L的NaAlO2溶液中,充分反应。两种混合方式生成沉淀的量是否相等 (填“相等”或“不相等”)
10-11学年度上学期高三期中考试四校联考化学试题 参考答案及评分标准
第Ⅰ卷(选择题 共54分)
22.(共14分)Ⅰ.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)  2KCl
+2MnCl2 +5Cl2↑+8H2O)
2KCl
+2MnCl2 +5Cl2↑+8H2O)
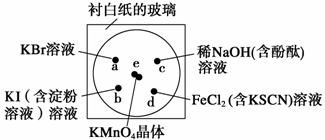
(1)e处反应的离子方程式为 。
该反应中氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象: 。d处的实验现象: 。(3)c处反应的化学方程式为 。
Ⅱ.混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应: ;
②混合物A中NaHCO3的质量为 g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的 Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com