
题目列表(包括答案和解析)
8.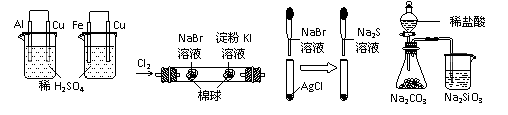 根据下列实验现象,所得结论正确的是
根据下列实验现象,所得结论正确的是
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
7.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
①.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
②.制备氢氧化铁胶体时,应向沸水中逐滴滴加1-2 mL饱和的FeC13溶液,并继续加热到液体呈透明的红褐色为止
③.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
④.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
⑤.除去蛋白质溶液中混有的NaC1,可以先加入AgNO3溶液,然后过滤
⑥.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
A.①② B.③④ C.④⑥ D.②③
6.下列各组离子,能在强碱性溶液中大量共存,滴加稀硫酸会产生气体和沉淀的是( )
A.K+、SiO32-、Cl-、CO32- B.Na+、S2-、Br-、SO42-
C.K+、Ca2+、NO3-、HCO3- D.Al3+、AlO2-、Cl-、SO32-
5.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用下图表示:
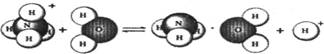
 则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
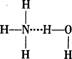
A.存在NH3·H2O,其结构式为 B.存在NH4+,其电子式为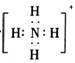
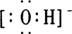
C.存在H3O+,其结构式为 D.存在OH-,其电子式为
4.某金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
3.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,1L液态水中含有的H+ 数目大于10-7NA
B.足量Zn与一定量的浓硫酸反应,标准状况下产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
D.1molFeCl3完全水解生成NA个胶体粒子
2.下列有关物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、碳酸钙高温分解、甲烷燃烧
A.①③④ B.②③④ C.③④ D.④⑤
1.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用反应物、产物中键能数据可判断对应反应的反应热
B.用沸点数据推测将一些液体混合物用分镏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用卤素阴离子半径数据推断其还原性的强弱
24.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
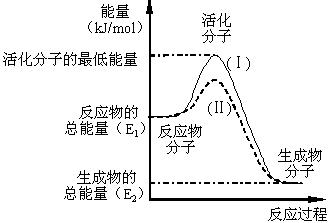
(1)图中所示反应(I)是________(填“吸热”或“放热”)反应,该反应的△H=__________(用含E1.E2的代数式表示)。
(2)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是___________。
(3)进一步研究表明,化学反应的焓变(△H)等于反应物和生成物的键能之差。以下是部分
化学键的键能数据:
试计算:2H2S(g)+SO2(g)= 3S(g)+2H2O(g);△H= – Q kJ·mol–1的反应热。反应产物中的S实为S8,实际分子是一个8元环状分子(如下图)。Q=_________。
(4)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。 已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ;ΔH= -25 kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ;ΔH= - 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ;ΔH= +19 kJ·mol-1
请写出CO还原FeO的热化学方程式: 。
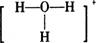
23.科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:①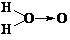 .②H-O-O-H。式中O→O表示配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。
.②H-O-O-H。式中O→O表示配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
d.用无水硫酸铜检验c的反应产物
(1)用电子式表示①.②两种结构:①____________.②___________。
(2)如果H2O2的结构如①所示,实验c中化学反应方程式为(A写结构简式,下同)____;
假如H2O2的结构如②所示,实验c中化学反应方程式为 ____ _。
|
化学键 |
H-S |
S-S |
S=O |
H-O |
|
键能/ kJ·mol–1 |
364 |
266 |
522 |
464 |
(3)我国科学家卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如下图所示,
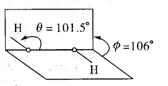 H2O2分子“有”“无”极性?
;
H2O2分子“有”“无”极性?
;
H2NCONH2与H2O2是通过 结合的。
 (4)央视《每周质量报告》曾报道有些不法商贩
(4)央视《每周质量报告》曾报道有些不法商贩
用硫磺熏蒸银耳、生姜、粉丝等食品,可使
食品雪白光亮。有些使用工业H2O2,使果肉
雪白鲜嫩来制果冻。二者漂白的原理不同,
前者是因为____而使物质漂白,后者则是双氧水的______性而使物质漂白。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com