
题目列表(包括答案和解析)
5.关于晶体的下列说法正确的是 ( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.晶体中分子间作用力越大,分子越稳定
4.下列过程没有破坏化学键的是 ( )
A.2O3 = 3O2 B.干冰升华
C.NaCl晶体受热融化 D.HCl体溶于水
3.类推的思维方法在化学学习与研究中常会产生错误的结论。因此,类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,正确的是 ( )
A.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可以写成PbO·Pb2O3
B.不能用电解AICl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁
C.Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3
D.FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体
2.NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.室温下,32gO2和O3的混合气体中氧原子数为2NA
B.将80gNaOH 固体溶解在1L的水中,所得溶液中NaOH的物质的量浓度为2mol/L
C.22.4L的O2中一定含有NA个氧分子。
D.标准状况下,22.4L的HI气体中,H+数为NA
1.下列说法没有科学性错误的是 ( )
A.“白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白。
B.液态氯化氢是100%的盐酸,其H+浓度极大。
C.氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面。
D.氯元素有毒,禁入口中。
23.(10分,每空2分) 不同的金属在化学反应中表现出来的活泼程度不同,早在1812年瑞典化学家贝采里乌斯根据大量实验现象首先提出了金属活动顺序的概念,后来俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是 、 。(写化学式)
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释 、 。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱 。
贵溪市第一中学2011届高三第一学期期中考试化学试题
22.(本题10分,每空2分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
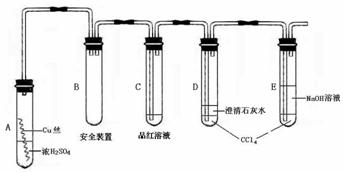
|
 实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。以下是该学习小组部分交流记录及后续探究实验的记录
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。以下是该学习小组部分交流记录及后续探究实验的记录
根据上述材料回答下列问题
(1)D、E两支试管中CCl4的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是: 。
设计实验验证你的猜想 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
21.(本题8分,每空2分) A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H 分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) ,
 E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y, X的电子式为 。
(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质在高温下发生置换反应的化学反应方程式
。
20.(10分,每空2分) 归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1)硒的熔点范围可能是 (2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_________________________________。
19. (本题10分,每空2分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右图所示(图中部分产物未列出):请填写下列空白
(本题10分,每空2分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右图所示(图中部分产物未列出):请填写下列空白
(1)A的化学式是 ,G的电子式 。
(2)H与盐酸反应生成E的离子方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com