
题目列表(包括答案和解析)
6、设NA为阿伏加德罗常数,下列说法中正确的是
A.常温下,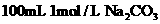 溶液中阴离子总数大于0.1NA
溶液中阴离子总数大于0.1NA
B.1mol冰中含有的氢键数目为NA
C.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
D.分子数为NA的N2、C2H4混合气体体积约为22.4L,质量为28g
5、下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液
A.①③④ B.① C.②③ D.③
4、下列各组离子在指定环境下能大量共存的是
A.pH=1的溶液中:Na+、S2-、K+、MnO4-
B.pH=7的溶液中:Al3+、Cl-、SO42-、HCO3-
C.pH=12的溶液中:Na+、AlO2-、SO42-、K+
D.pH=0的溶液中:Na+、K+、Fe2+、ClO-
3、下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
2、下列说法不正确的是
A.SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同
B.摩尔是七个基本物理量之一
C.电解质溶于水时一定存在化学能与热能的相互转化
D.同温同压下,3 molC2H4(g)和1 mol CO(g)的密度相等
1、大气中二氧化碳、甲烷和其他造成“温室效应”的气体大量排放,已使全球环境受到严重破坏。控制二氧化碳排放,需要从人人做起,“低碳生活”成为新的时尚潮流。下列不属于“低碳生活”方式的是
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机
B.尽量使用太阳能等代替化石燃料
C.减少使用一次性餐具 D.提倡塑料袋的无偿使用
31.现有等物质的量的KHCO3和NaHCO3的混合物a g与2 mol/L盐酸反应。题中涉及到的气体均以标准状况计。填空时,可用带字母的分式表示。
(1)该混合物中KHCO3和NaHCO3的质量比为______________。
(2)如果该混合物与盐酸恰好完全反应,则所用盐酸的物质的量是____________。
(3)如果盐酸过量,则生成CO2的体积是为______________L。
(4)如果反应后,混合物有剩余,盐酸量不足,除上述已知条件外,还应知道下列条件中的______________,才能计算生成CO2的体积。
A.盐酸的体积 B.盐酸的密度和质量分数 C.盐酸的质量
(5)如果KHCO3和NaHCO3不是以等物质的量混合,a g固体混合物与足量盐酸完全反应生成CO2,求CO2的体积(V)的取值范围,写出简明的计算过程。
|

|
版权所有:()
版权所有:()
 上海交通大学附属中学2010-2011学年度第一学期
上海交通大学附属中学2010-2011学年度第一学期
30.氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3 → 2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,则配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
⑵准确称取0.2500 g CuCl样品,放到足量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应为:
Fe3++CuCl → Fe2++Cu2++Cl- ; Ce4++Fe2+ → Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是 ,
是否符合标准: (选填“是”或“否”)。
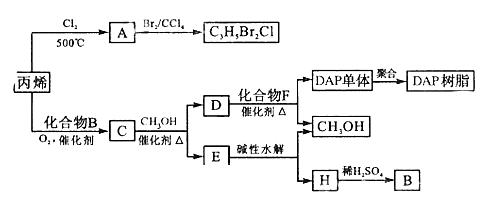
29.丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;
已知醇与酯可发生如下酯交换反应:
RCOOR’+R”OH RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是 , A含有的官能团名称是 ;
②由丙烯生成A的反应类型是
(2)A水解可得到D,该水解反应的化学方程式是 。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%,则C的结构简式是 。
(4)下列说法正确的是(选填序号字母)
A.C能发生聚合反应、还原反应和氧化反应
B.C含有2个甲基的羧酸类同分异构体有4个
C.D催化加氢的产物与B具有相同的相对分子质量
D.E有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是
(6)F的分子式为C10H10O4,DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是
。
28.化合物H是一种香料,存在于金橘中,可用如下路线合成:
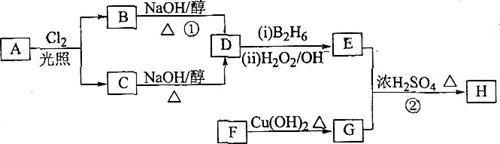
已知: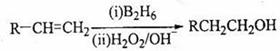 (B2H6为乙硼烷)。
(B2H6为乙硼烷)。
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧生成88gCO2和45gH2O。
则A的分子式是 ;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
、 ;
(3)在催化剂存在下1mol F与2mol H2反应生成3-苯基-1-丙醇。F的结构简式是
(4)反应①的反应类型是 ,
(5)反应②的化学方程式为 ,
(6)写出所有与G具有相同官能团的G的芳香族同分异构体的结构简式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com