
题目列表(包括答案和解析)
3、25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离出的OH-离子浓度之比为 ( )
A.1010:1 B.5×109:1 C.108:1 D.1:1
2、水的电离过程为H2O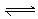 H++OH-,在25℃时水的离子积为KW=1.0×10-14,在35℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是
( )
H++OH-,在25℃时水的离子积为KW=1.0×10-14,在35℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是
( )
A.c(H+)随着温度的升高而降低
B.35℃时c(H+)>c(OH-)
C.35℃时的水比25℃时的水电离程度小
D.水的电离是个吸热过程
1、“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A、氯化钠 B、固体硝酸铵 C、固体氢氧化钠 D、生石灰
22、(6分)在标准状况下,将CO、CO2的混合气体(密度为1.43g/L)充入盛有足量Na2O2的密闭容器里,容器的容积(不计装入固体的体积)为2.24L。然后用电火花间断引燃气体混合物,直到反应完全,求:
(1)反应前CO和CO2体积比是多少?
(2)反应完全后,容器中存在的生成物是什么,物质的量各为多少?
新余一中2011届高中毕业年级第一次模拟考试
24.20 mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500ml、250ml、150ml的量筒备用,应选用量程为 的量筒
 (2)该实验应选用
(填“酸式”或“碱式”)滴定管
(2)该实验应选用
(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如右图),立即读数会使Na2O2的纯度
(填“偏高”“偏低”或“不变”);应进行的操作是
(4)在步骤④中用到的仪器除了容量瓶外还需要
(5)在步骤⑤中反应的离子方程式是
判定滴定达到终点的依据是
(6)该过氧化钠的纯度为 (用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)
21、(16分)Na2O2与水的反应实际是Na2O2 + 2H2O 2NaOH + H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2 2H2O
+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了
20、(10分)A、B、C是三种常见短周期元素的单质。常温下D为无色
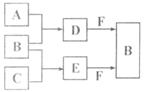 液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物
液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物
略去)。试回答: A
(1)E的结构式是 ,F的电子式是
(2)写出F与D反应的离子方程式并标出电子转移的方向和数
目 C
(3)物质Z与B互为同素异形体,它常用于对空气进行杀菌、净化和水果保鲜等。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,再通入0.4 mol E恰好完全被吸收,所得溶液中各种离子的浓度由大到小的顺序是 。
19、(8分)某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、
SO32-、SO42-,现取该溶液进行实验,实验结果如下:


(1)生成沉淀甲的离子方程式为__________________________________________
(2)由溶液甲生成沉淀乙的离子方程式为_________________________________
(3)沉淀丙可能是 (填化学式)
(4)综合上述信息,可以肯定存在的离子有
18、(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
17、(2分)下列有关几个定量实验的说法,正确的是_______________(填序号)
A.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
B.可用25ml碱式滴定管量取20.00mlNa2CO3 溶液
C.做测定硫酸铜晶体中结晶水含量的实验时,把加热得到的白色粉末放在空气中冷却会造成结果偏高
D.做测定硫酸铜晶体中结晶水含量的实验时,称量操作至少要有四次
E.在中和热的测定实验中,作为量热计的仪器装置,其保温隔热的效果一定要好
F.若酸碱用量不同,相同条件下测得的中和热数值不同
G.用NaOH固体配制一定物质的量浓度的NaOH溶液,所用的NaOH中混有Na2O会使配制的
NaOH溶液浓度偏高
H.仰视容量瓶刻线会使所配溶液的浓度偏高;开始仰视,放出溶液后俯视滴定管会使所量取的溶液体积偏小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com