
题目列表(包括答案和解析)
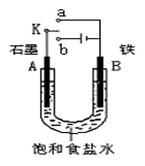
23、(6分)某课外活动小组同学用下右图装置进行实验,试回答下列问题。
⑴若开始时开关K与a连接,则B极的电极反应式为
。
|
座号 |
|
 ⑵若开始时开关K与b连接,总反应的离子方程式为
。
⑵若开始时开关K与b连接,总反应的离子方程式为
。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.4 mol电子
22、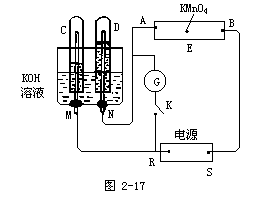 (8分)如图2-17,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(8分)如图2-17,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
(1)外电源的正、负极分别是R为 ,S 。
(2)A附近溶液的现象是 ,B附近发生的电极反应式为 .
(3)滤纸上的紫色点向哪方移动 (填A、B)。
 (4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为
,两极有关的反应式为
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为
,两极有关的反应式为
21、(5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数 (填“增大”、“减小”或“不变”).
(3)判断该条件下反应 (填能、不能)自发.
20、(7分)在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
|
|
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
|
A |
2 |
薄片 |
5 |
400 |
|
B |
2 |
薄片 |
15 |
200 |
|
C |
2 |
薄片 |
25 |
100 |
|
D |
2 |
薄片 |
35 |
t1 |
|
E |
2 |
细小颗粒 |
15 |
t2 |
|
F |
2 |
粉末 |
15 |
t3 |
|
G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
19、(1)(6分)下列物质中,属于强电解质的是 (填序号,下同),属于弱电解质的是 ,属于非电解质的是 。
A、NH4Cl B、CaCO3 C、SO2 D、蔗糖 E、NaCl溶液
F、NaHCO3 G、NH3·H2O H、液氯 I、铜
(2)(2分)0.3 mol B2H6(气态高能燃料)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 的热量,写出该反应的热化学方程式
。
(3)(2分)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
18、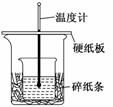 某实验小组学生用50
mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50
mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的作用是固定小烧杯
D.若改用50 mL 0.50 mol·L-1的盐酸跟50 mL 0.50 mol·L-1的KOH溶液进行反应,从理论上说所求反应热不相等
第Ⅱ卷(非选择题,共46分)
17、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:
A、反应达到平衡时,y的转化率为75%
B、反应可表示为X+3Y 2Z,其平衡常数为1600 (mol·L-1)-2
2Z,其平衡常数为1600 (mol·L-1)-2
C、增大压强使平衡向生成Z的方向移动,平衡常数不变
D、改变温度或向平衡体系中加入X都会使平衡移动,平衡常数也会随之改变
16、现有下列两个图象:
下列反应中符合上述图象的是( )
A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g)
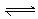 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g) 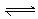 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g) 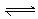 C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
15、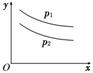
 反应L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断 ( )
反应L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断 ( )
A.上述反应正方向是放热反应 B.上述反应正方向是吸热反应
 C.a>b
D.a+1<b
C.a>b
D.a+1<b
14、在一密闭容器中,反应aA(g) 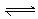 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是 ( )
A.平衡向正反应方向移动 B.物质A的转化率增大
C.物质B的质量分数增加 D.a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com