
题目列表(包括答案和解析)
5.在化合物A2B和BC2中,B的质量分数分别约为20%和30%,则在化合物A2BC3中B的质量分数最接近
A.5% B.10% C.15% D.20%
4.下列叙述错误的是
A.氨与酸反应生成铵盐 B.氨气与氯化氢气体相遇产生白烟
C.氨水中滴入酚酞溶液显红色 D.氨使湿润的蓝色石蕊试纸变红
3.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有
A.①③④⑤ B.全部 C.①②⑥ D.②③⑥
2.下列气体中,直接排放到大气而不会产生污染的是
A.NO B.O3 C.CH4 D.CO2
1.亚碘酸钠的化学式为
A.NaI B .NaIO C.NaIO2 D.NaIO3
20.(8分)
FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验步骤如下:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使Fe2+完全被氧化;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A.比m g多 B.比m g少 C.恰好为m g
(2)溶解样品时要加入盐酸,原因是 。
(3)配250mL溶液时,除需250mL容量瓶、烧杯外,还需用到的玻璃仪器是 、 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量:①NaCl ;②Fe2(SO4)3 (填“偏高”、“偏低”或“不变”)。
21(12分)A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:
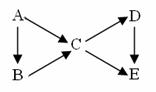 (1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
(1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
①Na ②N2 ③C ④S
(2)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液均显碱性,且等浓度时碱性C>D>E,B可做生氧剂,则B中含有的化学键类型为__________________;
A转化成C的离子方程式为: ________________________________,
D转化成E的离子方程式为_______________________________________。
(3)若常温下B、C、D均为气体,且B气体能使湿润的红色石蕊试纸变蓝
①在工业上生产B气体时为了加快反应速率应选择的条件是______________,其中能提高反应物的转化率的条件是___________。
②C、D是汽车尾气中的有害成分,用NaOH溶液吸收可消除污染,反应的化学方程式为__________________________________。
19.(10分)
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的原子结构示意图为 ;M在元素周期表中的位置为 ;前五种元素的原子半径从大到小的顺序是 (用元素符号表示)。Z、L两元素的第一电离能大小关系为: > (填写元素符号),原因是 。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子构型为 ,B的结构式为 。
(3)N是人体必需的微量元素,与L同一主族,N原子比L原子多两个电子层,则N的电子排布式为 ,其最高价氧化物对应的水化物化学式为 。
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: 。
18.(10分)Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液做如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液。
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体A生成,同时析出白色沉淀甲;
③在②所得溶液中再加入过量Ba(OH)2溶液,也有气体B生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是 ;一定存在的离子是 。可能存在的离子是 。
(2)写化学式:A: ;B: ;甲: ;乙中一定含 ,可能含 。
(3)碳酸氢铵溶液与过量Ba(OH)2溶液反应的离子方程式:
。
17.(12分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
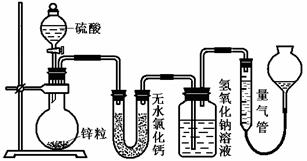 (1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:___________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将 (填偏大、偏小或无影响)
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①
②
16.在100mL某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入1.92g铜粉,微热,充分反应后溶液中c(Cu2+)为 ( )
A.0.15mol/L B.0.225mol/L
C.0.3mol/L D.无法计算
第Ⅱ卷 非选择题(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com