
题目列表(包括答案和解析)
4、电视台报道,近年来我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞。雾属于下列分散系中的
A.胶体 B.悬浊液 C.乳浊液 D.溶液
3、我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪)。关于185Hf的下列说法中,正确的是
A.是一种新元素 B.原子核内有185个质子
C.原子核内有185个中子 D.是183Hf的一种新的同位素
2、在下列物质类别中,前者包含后者的是
A.混合物 溶液 B.电解质 化合物
C.浊液 胶体 D.单质 化合物
1、既属于钠盐又属于硫酸盐的是
A.Na2SO3 B.Na2SO4 C.Na2S D.NaOH
24、(9分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示。

试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) __________________,其物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL(不考虑CO2的溶解,下同)。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) _____________,其物质的量之比为 ;
(3)计算原NaOH溶液的物质的量浓度(写出计算过程)。
23.(10分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种,某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:

[提出猜想]
Ⅰ.所得气体的成分可能只含 一种;Ⅱ.所得气体的成分可能含有 二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
[实验探究]
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想 正确;
(3)实验过程,仪器C的作用是 ;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
|
① |
6.4 |
2.88 |
224 |
|
② |
6.4 |
2.56 |
448 |
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组 ;
②组 。
22.(9分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的钠盐,甲中含B元素,乙中含D元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
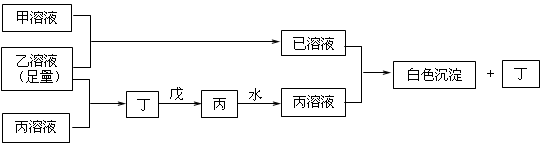
回答下列问题:
(1)元素B为: ,丁、戊的电子式分别为: . 。
(2)丁与戊反应的化学方程式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应;但生成物不是己和丁,
①写出将少量的乙溶液滴入甲溶液反应的离子方程式: 。
②写出将少量的乙溶液滴入丙溶液反应的离子方程式: 。
21.(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2BrO3一+10I一+12H+=5I2+Br2+6H2O 6BrO3一+5I一+6H+=5IO3一+3Br2+3H2O
②Br2能将I一氧化为I2:Br2+2I一=2Br-+I2
③KIO3能将I-氧化为I2,也能将Br一氧化成Br2,其本身被还原为12。
IO3-+5I-十6H+=3I2+3H2O 2IO3-+10Br-+12H+=I2+5Br2+6H2O
(1)在上述反应涉及的粒字中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1 mol KI的硫酸溶液中加KBrO3溶液,①若反应后的碘元素只存在于I2中,溴元素只存在Br一中,则加入KBrO3的物质的量为 mol;②若反应后的碘元素只存在于I2中,溴元素只存在Br2 和Br一中,则加入KBrO3的物质的量范围为
(4)将等物质的量KBrO3溶液和KI溶液在稀H2SO4中混合。写出发生反应的离子方程式 。
20.( 9) 由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 、NH4+、Mg2+、Ba2+、
、NH4+、Mg2+、Ba2+、 、
、 -。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 实验 内容 实验结果
内容 实验结果
1) 加AgNO3溶液 有白色沉淀生成
2) 加足量NaOH溶液并加热 收集到气体1.12L(已折算成标准状况下 的体积)
的体积)
3) 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 第一次称量读数为6. 27g,第二次称量读数为2.33g
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填"一定存在"、"一定不存在
"或"不能确定");根据实验1-3判断混合物中一定不存在的离子是
。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度:
阴离子符号 物质的量浓度分别
(3)试确定K+是否存在? ,判断的理由是
19、(8分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术创新必不可少的关键原料之一,可 由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
(1)上述反应中,氧化剂与还原剂的物质的量之比为_________ _____;若反应中有0.5 mol NH3 被氧化,转移电子的数目为
。
_____;若反应中有0.5 mol NH3 被氧化,转移电子的数目为
。
(2)在潮湿的空气中,NF3 能与水蒸气发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,则在NF3、F2 、NO三种气体中,氧化性由弱到强的顺序 。
(3)一旦NF3 在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 ______
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com