
题目列表(包括答案和解析)
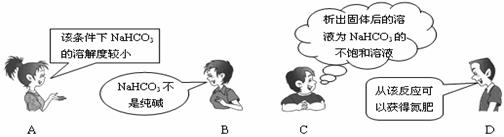
5.“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的"侯氏制碱法"的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
4.某溶液中含有:①HCO3-、②SO32-、③CO32-、④NO3-等四种阴离子,向其中加入足量Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
A.② B.②、③ C.①、④ D.④
3.下列有关物质用途的叙述中,不正确的是
A.硅可用作制造变压器的铁芯材料 B.石英玻璃可用于制造光学仪器
C.二氧化硅可用于制造光导纤维 D.水泥、玻璃、水晶饰物都是硅酸盐制品
D.水泥、玻璃、水晶饰物都是硅酸盐制品
2.下列矿物的主要成分中,既含铁元素,又含铜元素的是
A.赤铁矿 B.孔雀石 C.黄铜矿 D.石灰石
1.化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一
B.在食盐中加入适量的碘酸钾,是因为碘酸钾具有较强的氧化性,可抗人体老化
C.2009年,中国水电装机容量、核电在建规模、太阳能热水器集热面积和太阳能光伏发电累计容量均居世界第一位
D.竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体
33.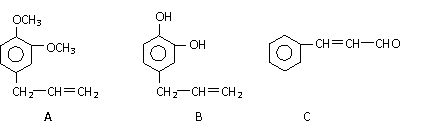 (16分)从某些植物树叶提取的挥发油中含有下列主要成分:
(16分)从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是 (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为 。
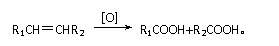 (3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(3)0.5molB与足量的溴水充分反应,消耗
mol单质溴。
(4)已知: 有机物C9H8O发生如下反应:

则C9H8O的结构简式为 。
(5)写出A在一定条件下生成高分子化合物的化学方程式:
。

已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
|
密度/g·mL-1 |
沸点/℃ |
溶解性 |
|
溴乙烷 |
1.461 |
38 |
难溶于水 |
|
乙醇 |
0.789 |
78 |
易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,本实验采取了 ____________________________________________________________的措施。
32. (16分)
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁的化合物。
(1)黄铜矿的组成元素中,属于副族元素的是__________(填写名称,下同);属于主族元素的是_____,它位于周期表的位置是__________,它的原子半径________Cl的原子半径(填“>”、“<”或“=”,下同),它的气态氢化物的稳定性____HCl。
(2)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),氧化产物是___________(填化学式)。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (请配平)。
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
28.(16分)下图表示各物质(均为前20号元素组成)之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性氧化物,L是一种白色沉淀,F是常见无色液体。
试回答下列有关问题: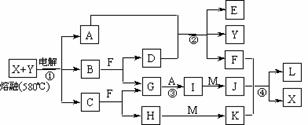
(1)M的化学式 ,Y在实验室中的用途 (列举一例)。
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
(3)A和氨气反应有白烟和新的单质生成,写出化学反应方程式 。其中还原剂与还原产物的物质的量之比为 。
(4)反应④的离子反应方程式是 。
27.(12分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
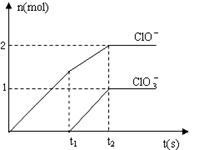 (1)t1时,开始有C1O3-生成的原因是
(1)t1时,开始有C1O3-生成的原因是
__________________________________________________
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:
。
(3)该石灰乳中含有Ca(OH)2的物质的量是__________ mol
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为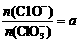 ,则n(C1-)= ___ mol(用含a的代数式来表示)。
,则n(C1-)= ___ mol(用含a的代数式来表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com