
题目列表(包括答案和解析)
13.向含有FeCl3和BaCl2 的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是( )
A.白色沉淀是FeSO3 B.白色沉淀是BaSO3和BaSO4的混合物
C. FeCl3已全部被SO2氧化成FeCl2 D. 白色沉淀是BaSO4
12. 对某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
C.加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,一定有NH4+
D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸沉淀消失,一定有Ba2+
11. 将5.6g Cu、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下混合气体VL(HNO3被还原为NO和NO2);若向反应后的溶液中加入足量氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称量质量为10.7g,则收集到的气体体积V值可为 ( )
A、2.24L B、4.48L C、6.72L D、7.84L
10.NH3和H2O,NH+4和H3O+,NH-2和OH-,N3-和O2-,从某些性质来看,每组中的物质两两相似。据此判断,下列反应中正确的是 ( )
A.Cu+2NH3=Cu(NH2)2+H2↑
|
C.3Mg(NH2)2====Mg2N2+4NH3↑ D.NaCI+2NH3===NH4Cl+NaNH2
9.下列各组溶液,不用任何试剂就可以将它们区别开来的是 ( )
A.硫酸钾、氢氧化钠、氯化铝、氯化钠 

B.硫酸铝、氢氧化钾、碳酸氢钠、氯化钡
C.盐酸、硝酸钙、氯化钠、碳酸氢钾
D.硫酸镁、氢氧化钠、碳酸钾、硫酸钾
8、下列说法正确的是 ( )
A、弱酸和强酸盐发生复分解反应时,一定不能制得强酸
B、熔融态的氯化钠导电属于物理变化
C、含有金属元素的离子一定都是阳离子;只含有非金属元素的离子一定都是阴离子
D、Fe(OH)3胶体的聚沉属于物理变化
二:选择题(每小题只有一个正确答案,每小题3分,共30分)
7.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.Na2O2与CO2反应产生1molO2,转移的电子数为4NA
B.2.24LN2和NH3混合气体中原子间一定有存在3NA个共用电子对
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+
D.2molSO2和1molO2 混合在V2O5存在的条件下密闭容器中加热反应后,容器内物质分子数大于2 NA
6. 已知NH3和HCl都是能用来作喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl气体未满,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系
已知NH3和HCl都是能用来作喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl气体未满,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系
是(不考虑溶质的扩散及静止时液面高度的影响) ( )
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
5.下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B. ②④ C.③⑥ D.⑤⑥
4.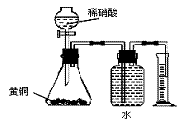 下列实验操作正确的是
( )
下列实验操作正确的是
( )
A.氢氧化钠固体放在滤纸上称量
B.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中 Zn的含量
C.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl
D.配制0.184 mol/L H2SO4时,向1000 mL容量瓶中注入10 mL 18.4 mol/L H2SO4然后边加水边振荡,最后定容
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com