
题目列表(包括答案和解析)
1.下列关于化学基本概念和基本理论的几点认识中正确的是 ( )
A.原子是化学变化中的最小微粒,通过复杂的化学反应可以产生新的原子
B.有电子转移的过程不一定产生电流,但其化学反应一定是氧化还原反应
C.胶体区别于其他分散系的本质特征是具有丁达尔现象
D.强电解质溶液的导电能力一定强于弱电解质溶液
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Fe 56
第I卷(选择题)
本卷包括14小题,每小题3分,共42分。在每题列出的四个选项中,只有一项是最符
合题目要求的
6.64-1.68-(0.9-0.18))/106=0.04mol
4) NaHCO3的物质的量=1.68/84=0.02mol
水的物质的量=(0.9-0.18)/18=0.04mol
该天然碱的化学式为:
2Na2CO3.NaHCO3.2H2O
29.(12分)
(1)① ⑦
(2)①C ②用pH试纸分别测定两溶液的pH (其他合理答案均可)
(3)①加热;因加热操作方便、简单,试剂节省且又不引入新的杂质;加盐酸看是否有气泡或加消石灰加热,用湿润的红色石蕊试纸鉴别(其他合理答案均可) ②BaCl2;Na2CO3;过滤;盐酸;漏斗、玻璃杯、烧杯;取pH=7的溶液加BaCl2 后看是否有白色沉淀生成。
23、(8分)
27. (12分)
(1)d、e
(2)FeCl3 2Fe3+ + Fe === 3Fe2+ 保证溶液中Fe2+为主
向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色
(3)Al(OH)3 ;HCl ;NaOH
AlO2-+ H+ + H2O == Al(OH)3
或 Al3++3OH-=== Al(OH)3 ,或Al(OH)4-+ H+ == Al(OH)3 + H2O 也可得分

26.(6分)①HCO3- Ba2+ Fe2+ 、HSO3-、I -
②Al3+ SO42- NO3-、Mg2+③Cl-、K+
-
②Al3+ SO42- NO3-、Mg2+③Cl-、K+
29.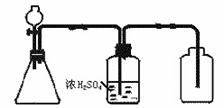 (1)右图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是 _▲ (填代号)。
(1)右图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是 _▲ (填代号)。
①亚硫酸钠和硫酸 ②二氧化锰和浓盐酸 ③浓氨水和生石灰④石灰石和稀硫酸 ⑤锌和稀硫酸 ⑥硫化亚铁与稀硫酸 ⑦双氧水和二氧化锰
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是____▲___(填代号)。
A.氢氧化钠溶液 B.甲基橙溶液 C.稀盐酸 D.澄清石灰水
②除上述方法外,你认为是否还有其它的方法,具体如何操作___▲____。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是 ▲ ,其理由是
▲ 。
②以下是除去SO42-的实验方案 。
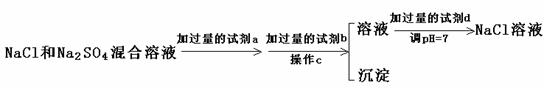
过量的a试剂是 ▲ ,C操作中所使用的玻璃仪器的名称是 ▲ ,证明SO42-已经沉淀完全的方法是
▲  。
。
30. 某纯净的天然碱可看作二氧化碳和氢氧化钠反应的产物。取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的浓硫酸、过量澄清石灰水后,浓硫酸增重0.9g,澄清石灰水中生成沉淀1g。
(1)充分加热后,剩余固体重 ▲ g。
(2)该天然碱成分中除含有碳酸钠外,还含有 ▲ 。(填化学式)
(3)6.64g天然碱中,含碳酸钠的物质的量为 ▲ mol。
(4)该天然碱的化学式为 ▲ 。
|
绍兴一中 高三化学期中考答题纸
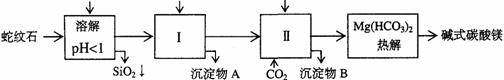
28.蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__▲_ __
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致____▲_____溶解、____▲_____沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_____▲____ (填入物质的化学式),然后________________▲__________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_______▲______(填写物质化学式)。
(5)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式 ▲ 。
(6)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数▲ (填 “升高”、“降低”或“不变”)。
27.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
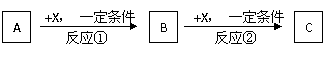
试回答:
(1)若X是强氧化性单质,则A不可能是 ▲ 。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ▲ ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)
 ▲ 。
▲ 。
检验此C溶液中金属元素价态的操作方法是 ▲ 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ▲ ,X的化学式可能为(写出不同类物质) ▲ 或 ▲ 。
反应①的离子方程式为 ▲ 。
26.一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在pH试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ▲ ;肯定存在的离子是 ▲ ;不能作出判断的离子是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com