
题目列表(包括答案和解析)
6、某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于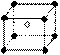 此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是 ( )
此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是 ( )
A.1∶8 B.1∶4
C.1∶2 D.1∶1
5、下列化学式能真实表示物质分子组成的是 ( )
A.NaOH B.SO3 C.CsCl D.SiO2
4、在溶液中能大量共存的一组离子或分子是 ( )
A.NH4+ H+ NO3- HCO3 - B.Al3+ Na+ SO42- NH3·H2O
C.Na+ K+ SO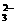 Cl2 D.Na+ CO32- OH- CH3COO-
Cl2 D.Na+ CO32- OH- CH3COO-
3、下列物质中,属于不晶体的是 ( )
A.玻璃 B.铜 C.水晶 D.干冰
2、下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是 ( )
A.SO3+H2O=H2SO4 B.3NO2+H2O=2HNO3+NO
|
C.3Fe+4H2O(g) ==== Fe3O4+4H2 D.2F2+2H2O=4HF+O2
1.下列叙述中,正确的是 ( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.晶体中只要有阳离子就会有阴离子
D.电子数相同的阳离子和阴离子一定不具有相同的质子数
27.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、
、 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
26.(11分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH-、C1-、CO32-、NO3-、SO42-
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。
试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈碱性的原因 (用离子方程式表示)。
(3)在100mL0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为 。
25. (23分)中学化学中几种常见物质的转化关系如图19所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
(23分)中学化学中几种常见物质的转化关系如图19所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围 。
(2)写出D、E的化学式:D 、E
(3)①写出H2O2的电子式:
②写出E的酸性溶液与双氧水反应的离子方程式 。
(4)写出检验F中阳离子的实验操作、现象及有关反应的离子方程式。
实验操作 ;
现象 ,离子方程式 。
(5)在E溶液中加入与E等物质的量的Na2O2能恰好使E转化为H,写出该反应的化学方程式 。
24.(15分)已知:A、B、C均为常见的单质或化合物,它们在一定条件下有如下关系
A+H2O→B+C
(1)若A可作为呼吸面具和潜水艇中氧气的来源,则A与水反应的方程式为
;
(2)若A、B、C均为化合物,且B是酸,则该反应的化学方程式为 ;
(3)若B、C均为酸,则该反应的化学方程式为 ;
(4)若C为H2。B为氧化物,则A可能是(填化学式) 、 、
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com