
题目列表(包括答案和解析)
2.开发新材料是现代科技发展的方向之一。下列有关材料的说法不正确的是
A.硅钢属于金属材料
B.氧化铝陶瓷和光导纤维属于新型无机非金属材料
 C.
C.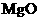 的熔点低于Al2O3,不可用于制作耐高温材料
的熔点低于Al2O3,不可用于制作耐高温材料
D.阳离子交换膜属于有机高分子材料
1.下列措施有利于节能减排、改善环境质量的有( )
 ①在我国核电站已安全运行多年的基础上,兴城等地也将发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
①在我国核电站已安全运行多年的基础上,兴城等地也将发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
 ②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
 ③加速建设地铁、轻轨等轨道交通,促进沈大城市一体化发展,减少汽车尾气排放
③加速建设地铁、轻轨等轨道交通,促进沈大城市一体化发展,减少汽车尾气排放
 ④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
 ⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
 ⑥用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
⑥用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
 ⑦用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
⑦用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
⑧.用家用汽车代替公交车
 A.①②③④⑥⑦
B.①②⑤⑦ C.①②④⑤⑥ D.③④⑤⑥⑦
A.①②③④⑥⑦
B.①②⑤⑦ C.①②④⑤⑥ D.③④⑤⑥⑦
21.(10分)高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能水处理剂,生产工艺如下:
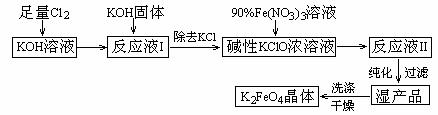
已知: ① 温度较低时: 2KOH + Cl2 → KCl + KClO + H2O
② 温度较高时: 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
③ Fe(NO3)3 + KClO + KOH → K2FeO4 +KNO3 + KCl + H2O(未配平)
(1)该生产应在温度 的情况下进行(填“较高”或“较低”);
(2)请配平反应③:
Fe(NO3)3 + KClO + KOH → K2FeO4 + KNO3 + KCl + H2O
(3)K2FeO4具有强氧化性的原因为 ;
(4)在“反应液I”中加KOH固体的目的是 :
A.为下一步反应提供反应物
B.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
C.KOH固体溶解时会放出较多的热量,有利于提高反应速率
D.使副产物KClO3转化为 KClO
(5)若从“反应液II”中分离出m g K2FeO4 ,则理论上至少消耗________L的氯气(标准状况下)
20.(10分)某同学用如下实验装置及化学药品制取氨气并研究氨气的催化氧化。请你按要求回答下列问题: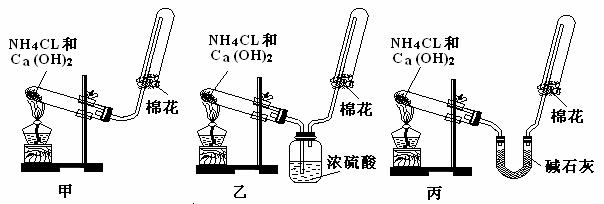
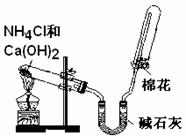
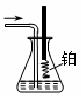
A B
(1)该同学制取氨气的化学方程式为 。
(2)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_________________。
(3)一段时间后,将收集氨气的试管倒立在水槽中,观察到试管内液面最终只上升到试管的一半。若不考虑试管内溶质扩散到水槽中,则标准状况下,试管内溶液的物质的量浓度为 。
(4)用B装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入B装置的锥形瓶内,写出锥形瓶内氨氧化的化学方程式 。
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
19.(12分)“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题: (1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
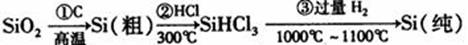
a、写出步骤①的化学方程式 。此反应不能证明C的非金属性比Si强,请你用一个化学方程式来说明C的非金属性比Si强的事实 。 b、步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3的主要化学操作的名称是 ;
(2)磁性材料。这种材料一般含有铁元素,铁以化学性质活泼用途广泛而著称。其中在工业上常用于印刷电路板工业,请写出反应的离子方程式
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明: ,
。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是 ,区分胶体和溶液最经典的方法是
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[AlFe(OH)nCl6-n]m 就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为 。已知乙醇是有机高分子材料合成过程中的重要物质,请写出工业上以乙烯为原料制乙醇的化学方程式
18.(10分)(1)某无色混合溶液,,只可能含有以下离子中的若干种:Na+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -、Cu2+,
现取三份100 mL溶液进行如下三步实验:
第一步:第一份加入AgNO3溶液有沉淀产生
第二步:第二份加足量NaOH溶液加热后,收集到气体0.08 mol
第三步:第三份加足量BaCl2溶液后,得干燥A沉淀6.63 g,经足量盐酸洗涤、干燥后,沉淀B质量为4.66 g。根据上述实验推测:
①混合物的水溶液一定含有的离子是 ;
②可能含有的离子是 ,进一步确认还需采用的方法是
(2)

根据上图完成下列问题:
①写出A、C、E的化学式
A____________________C_____________________E_______________________
②写出下列反应的化学方程式
C、D按体积比1:1通入水中:_________________________________________
17.(10分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)Z、W形成的气态氢物的稳定性为 > 。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。
过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①由实验a 、b 推知B溶液中含有的离子为
②B的化学式为 。
16.将2.4gFe、Mg合金投入到一定量的稀硝酸中,恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为 ( )
A.3.36 B.1.016 C.1.00 D.0.986
15.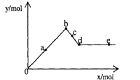 已知Ba(AlO2)2可溶于水。右图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述错误的是 ( )
已知Ba(AlO2)2可溶于水。右图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述错误的是 ( )
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.b-c时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:Al(OH)3一定小于BaSO4
D.d-e时溶液中离子的物质的量:Ba2+可能等于AlO2-
14.将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe (NO3)x + NO↑+14H2O 。下列判断合理的是 ( )
A.Fe (NO3)x中的x为2
B.磁性氧化铁中的铁元素全部被氧化
C.稀HNO3 在反应中只作氧化剂
D.反应中每生成0.4 mol 还原产物,就有1.2 mol 电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com