
题目列表(包括答案和解析)
4.下列说法中正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.金属氧化物一定不能与碱发生反应
3.在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过
实践的检验才能确定其正确与否。下列几种类推结论中,不正确的是( )
A.CO2不能与CaCl2溶液反应,则SO2也不能与CaCl2溶液反应
B.金属钠着火不能用CO2扑灭,则金属钾着火也不能用CO2扑灭
C.乙烯能使酸性KMnO4溶液褪色,则丙烯也能使酸性KMnO4溶液褪色
D.Al(OH)3能与NaOH溶液反应,则Al(OH)3也能与氨水反应
2.下列有关实验的叙述中,正确的是 ( )
①用湿润的pH试纸测定溶液的pH
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体
③可用加热法分离I2和NH4Cl的混合物
④可用稀硝酸洗涤“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最
后加入少量铁粉
A.①②④ B.②③⑥ C.②④⑥ D.②③④⑤⑥
1.化学与生活、社会密切相关。下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
24.(12分)某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置F中发生反应的离子方程式是 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B 、D 、E 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;
装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵: 。
(5)若从装置C的G处逸出的尾气中含有N2和少量C12,应如何处理?
。
附加题 (10分)小苏打、胃舒平、达喜都是常用的中和胃酸的药物.
(1)小苏打片每片含0.50 g NaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是________mol.
(2)胃舒平每片含0.245 g Al(OH)3.中和胃酸时,6片小苏打片相当于胃舒平_______片.
(3)达喜的化学成分是铝和镁的碱式盐.
①取该碱式盐3.01 g,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比为__________________.
② 在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74 g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式为: 。
23.(10分)位于短周期的四种主族元素 A、B、C、D,原子序数依次增大,已知 A、C 位于同一主族,B、D 的最外层电子数相等,且 B、D 的原子序数之和为 A、C 原子序数之和的两倍,C为金属元素,其焰色反应为黄色。根据你的推断回答下列问题:
(1)四种元素的名称依次为 、 、 、 ;
(2)请写出含 B 质量分数最高的化合物的电子式 ;
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式:
、 、 、 ;
(4)仅由 B、C、D 三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
22.(8分)已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1∶1混合加热,E、F、J是常见的气体单质,有如下转化关系:
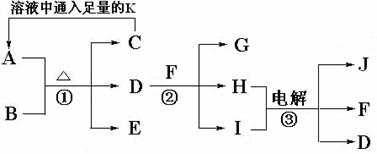
(1) 试判断A____________B____________C____________D___________(写化学式)。
(2) 写出A与D反应的离子方程式___________________________________________;
(3) 写出②反应的化学方程式____________________________________________。
(4) 一定条件下将aL的K通入一定量的B中,反应后气体体积变为bL,则参加反应的K为_________________L。
21.(10分)Cl2通入 70℃ 的 NaOH 水溶液中,发生氧化还原反应,反应完成后,测得溶液中NaClO与 NaClO3的物质的量之比为 4∶1。则:
(1)配平溶液中所发生反应的化学方程式为:
Cl2+ NaOH ==== NaCl+ NaClO3+ NaClO +
(2)反应中的氧化剂是 ,氧化产物为 。
(3)此反应的离子方程式为 。
(4)每生成 1molNaClO,反应中转移的电子总数是 mol,若溶液的体积正好为 500mL,则溶液中 NaCl的物质的量浓度为 mol/L。
20.氕化锂、氘化锂、氚化锂可以作为长征2号火箭发射的重要燃料,下列说法正确的是
A.H、D、T之间互称同素异形体 B.氕化锂、氘化锂、氚化锂起催化剂作用
C.LiH、LiD、LiT的摩尔质量之比为1﹕2﹕3 D.它们都是强还原剂
第Ⅱ卷(非选择题 共40分)
19.不具有放射性的同位素称之为稳定同位素.稳定同位素分析法在近20年来植物生理学、生态学和境科学研究中获得广泛应用。如在陆地态系统研究中2H、13 C、15 N、18O、34S等常用作环境分析指示物下列说法正确的是
A.34S原子核内中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+ 的酸性比1H+ 的酸性更强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com