
题目列表(包括答案和解析)
19.下列说法正确的是
A.SO2通入BaCl2溶液中无现象,但在BaCl2溶液先加入氨水、氯水、氯化铁、氢硫酸等溶液后再通SO2气体均有沉淀
B.检验Na2SO3是否氧化变质只需加BaCl2溶液即可
C.SO2使溴水、含酚酞的氢氧化钠溶液、酸性高锰酸钾溶液均褪色,均体现了SO2的漂白性
D.将16mol/LH2SO4溶液50g加水稀释至8mol/L需加入50g的水
18.已知反应N2(g)+3H2(g)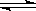 2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应,下图是某物理量Y随时间(t)变化的示意图,Y不可以是
2NH3(g);△H<0,向某容积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应,下图是某物理量Y随时间(t)变化的示意图,Y不可以是
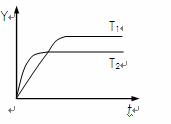
A.混合气中氨的体积分数 B.混合气体的密度
C.N2的转化率 D.混合气体的平均摩尔质量
17.某1L溶液中含有大量的Cl-、Br-、I-,若向1L该溶液中通入一定量的氯气,溶液中Cl-、Br-、I-的物质的量与通入的氯气的体积(标准状况)的量关系如下表所示,分析后判断下列说法正确的是:
|
V(Cl2)(标况) |
2.8L |
5.6L |
11.2L |
|
n(Cl-) |
1.5mol |
1.75mol |
2.25 mol |
|
n(Br-) |
1.5mol |
1.4mol |
0.9 mol |
|
n(I-) |
amol |
0 |
0 |
A.当通入氯气的体积为2.8L时,溶液中发生的离子反应式只有:Cl2+2I-=2Cl-+I2
B.表中a的值为0.4
C.原溶液中Cl-、Br-、I-的物质的量之比为15:15:8
D.原溶液中I-的物质的量浓度为0.25mol/L
16.下列叙述正确的是
A.同温同压下,相同体积的任何两物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
15.下列划有横线的反应物在反应过程中不能完全消耗的是
A.将含少量CO2的CO通入足量Na2O2的试管并不断用电火花引燃
B.向等物质的量的干冰和CaO的混合物中加几滴水
C.将1molCu和置于含2molH2SO4的浓硫酸中
D.在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2
14.下列有关实验操作说法中,正确的是
①用pH试纸测得氯水的pH为2 ②用碱式滴定管量取25.00mL溴水 ③可用渗析的方法除去淀粉中混有的少量的NaCl杂质 ④在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体 ⑤分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 ⑥用结晶法可以除去硝酸钾中混有的少量氯化钠
A①③④ B ③⑤⑥ C ①②③⑤ D全部
13.25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466g 沉淀。滤液跟2.00mol/L氢氧化钠溶液反应,共用去10.00mL碱液时恰好中和。下列说法中正确的是
A.原混合液中c(SO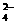 )=0.20mol/L B.原混合液中c(NO
)=0.20mol/L B.原混合液中c(NO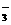 )=0.90mol/L
)=0.90mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.10mol/L
12.下列对一些实验事实的理论解释正确的是
|
选项 |
实 验 事 实 |
理 论 解 释 |
|
A. |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
|
B. |
白磷为正四面体分子 |
白磷分子中P-P间的键角是109°28′ |
|
C. |
1体积水可以溶解700体积氨气 |
氨是极性分子且由于有氢键的影响 |
|
D. |
HF的沸点高于HCl |
H-F的键长比H-Cl的键长短 |
11.已知A、B是第一周期以外的短周期元素,它们可以形成离子化合物AmBn。在此化合物中,所有离子均能形成稀有气体原子的稳定结构。若A的核电荷数为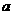 ,则B的核电荷数不可能是
,则B的核电荷数不可能是
A.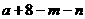 B.
B.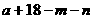 C.
C.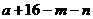 D.
D.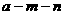
10.X、Y、Z、W、R是5种短周期元素,其原子序数依次增加。X是元素周期表中原子半径最小的的元素, Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是:
A.元素Y、Z、W具有相同电子层的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
D.元素W、R的最高价氧化物的水化物都是强酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com