
题目列表(包括答案和解析)
2、绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列符合绿色化学实验的是( )
A.用铜与浓硫酸反应制取CuSO4,并用少量品红溶液吸收尾气
B.将CO还原Fe2O3后的尾气直接排入空气中
C.用CCl4完成萃取操作练习时,将溴水改成碘水
D.将Zn和稀硫酸制H2后的废液倒入水槽后再清洗玻璃仪器
1. 起固定氮作用的化学反应是 ( )
A.N2与H2在一定条件下反应生成NH3
B.NO与O2反应生成NO2
C.由NH3制NH4HCO3和(NH4)2SO4
D.NH3经催化氧化生成NO
23.(8分)
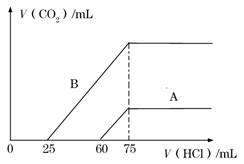
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.l mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 ,
其物质的量之比为 。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为 mL。
22.(8分)
下图中A-K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体,且A是一种不含金属元素的盐,受热分解能得到三种物质的量相等的产物,A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D(D为无色无味气体);C为淡黄色固体。各物质间的转化关系如下图所示:

请回答下列问题:
(l)写出C的化学式 。
(2)写出固体A的溶液与足量NaOH溶液加热反应的离子方程式
。
(3)写出实验室制取B的化学方程式
。
(4)写出N与K反应的方程式
。
21.(14分)
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
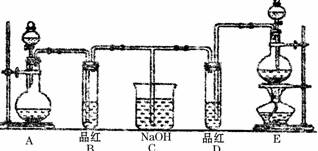
(1)实验室常选用制CO2的发生装置制SO2,实验室用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 装置(填装置序号)制Cl2,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸,反应离子方程式为
。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为
B: ,
D: 。
(3)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。

试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:
(结合反应方程式)。
20.(8分)
有A、B、C、D四种可溶性盐,其阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、Cl-、SO42-、CO32-中的某一种,每种离子只存在于一种物质中,不能重复出现。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,可见到A溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,则B溶液有白色沉淀产生,C溶液有无色无味气体产生。
根据以上实验可推知四种盐的化学式分别是:A ,B ,C ,D 。
19.(8分)
Ⅰ.将W g胆矾(CuSO4· 5H2O)溶解在V mL水中,得到饱和溶液,测得该饱和溶液的密度为籽 g/cm3,测溶液的物质的量浓度为 。
Ⅱ.用98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
(1)需要用量筒量取浓硫酸 mL。
(2)配制操作可分解成如下几步,正确的操作顺序是 。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)由于错误操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数
B.使用容量瓶配制溶液时,俯视液面定容后所得溶液浓度
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有烘干
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.把配制好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
18.高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上常用下列反应先制高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是( )
A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成1molNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
第Ⅱ卷(46分)
17.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
16.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。
|
|
A.由Fe+S====FeS 推测:Fe+Cl2====FeCl2
B.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,
推测:CO2+NaClO+H2O=NaHCO3+HClO
C.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,
推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D.由Na2SO3+2HCl=2NaCl+H2O+SO2↑,
推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com