
题目列表(包括答案和解析)
6. CH4在一定条件下经催化氧化可以生成C2EH2 和C2H4,现取一定量的CH4,经上述催化氧化后得到混和气体,它在标准状况下的密度为0.7698克/升。已知反应中CH4消耗了20%,计算混和气体中C2H2的体积百分含量(保留三位有效数字)。
5. 已知某混和气体的体积百分组成中有80.0%的CH4、15.0%C2H2、5.0%的C2H4,
请计算0.5摩尔该混和气体的质量和在标准状态下的密度(克/升)。
[解答]:
4. 取50.0毫升Na2CO3 和Na2S 的混和溶液,加入过量的AgNO3 溶液后,得到3.86克
沉淀;用过量的稀醋酸处理后,沉淀量减少到2.48克,并有气体放出。
请计算:
(1) 原混和溶液中Na2CO3 的摩尔浓度是( )摩/升.
Na2S 的摩尔浓度是( )摩/升。
[解答]:
(2) 产生的气体在标准状态下的体积。( )升。
[解答]:
3. 虽然有机化合物A、B的分子式不同,但它们所含元素只可能是碳、氢、氧中的两种或三种。如果将A、B以任何一种比例混合,只要其物质的量之和不变,完全燃烧时所消耗的氧气和生成的水的物质的量也不变,则A、B组成必须满足的条件_______________________。
[解答]
2. 根据以下反应事实:
(1) 甲苯可使酸性KM O4 溶液褪色,其反应是C6H5CH3
被氧化为C6H5COOH;
O4 溶液褪色,其反应是C6H5CH3
被氧化为C6H5COOH;
(2) CH3COONa
+ NaOH  Na2CO3
+ CH4↑
Na2CO3
+ CH4↑
请写出甲苯制成苯的各步反应式。
[解答]
1. CH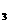 COOH是一种弱酸,而氯乙酸(CH
COOH是一种弱酸,而氯乙酸(CH CLCOOH)的酸性强于CH
CLCOOH)的酸性强于CH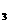 COOH,这是因为-CL是一种强吸引电子基团,能使-OH上的H 原子具有更大的活动性。有的基团属于斥电子基团,能减弱-OH上H 原子的活动性,这种作用叫“诱导效应”。
COOH,这是因为-CL是一种强吸引电子基团,能使-OH上的H 原子具有更大的活动性。有的基团属于斥电子基团,能减弱-OH上H 原子的活动性,这种作用叫“诱导效应”。
根据以上规律判断:
(1). HCOOH 显酸性,而H O 呈中性,这是由于HCOOH分子中存在____电子基团,
O 呈中性,这是由于HCOOH分子中存在____电子基团,
这种基团是_________。( )
(A) 吸,羟基 (B) 吸,羧基
(C) 斥,羧基 (D) 斥,羟基
(2). CH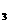 COOH 的酸性弱于HCOOH,这是由于CH
COOH 的酸性弱于HCOOH,这是由于CH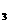 COOH 分子中存在(斥)电子基团,
COOH 分子中存在(斥)电子基团,
这种基团是(甲基)。
请判断:( )
(3). 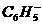 (苯基)也属于吸电子基团,所以
(苯基)也属于吸电子基团,所以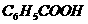 (苯甲酸)酸性比乙酸的酸性
(苯甲酸)酸性比乙酸的酸性
( )。
(填 1---“强”或 2---“弱”)。
5. A、B、C是由周期表中短周期元素间组成的三种化合物,它们各由两种元素组成,甲、
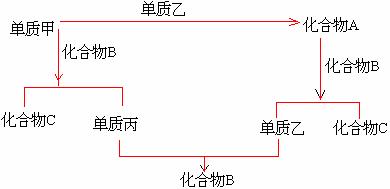 乙、丙是三种单质,这些单质和化合物之间存在如下关系。
乙、丙是三种单质,这些单质和化合物之间存在如下关系。
(1). 据此判断:单质甲必定是( )
( 填 1---“金属” 或 2---“非金属” ).
(2). 据此判断:单质乙的分子式可能是( ).
(A)O (B)Na
(B)Na O
O
(C)H O
(D)NaOH
O
(D)NaOH
(3). 据此判断:化合物A、B、C的分子式分别是( ).
(1) O (2) Na
(2) Na O
O (3) H
(3) H O (4) NaOH
O (4) NaOH
(A) (1) (2) (4) (B) (2) (4) (3)
(C) (2) (3) (4) (D) (3) (1) (2)
3. 在冶金工业的烟道废气中,常混有大量的SO2和CO ,它们都是大气的污染物,在773 K
和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫磺。
请写出该反应的化学方程式:SO + 2CO = 2CO
+ 2CO = 2CO + S .
+ S .
请判断:( )
 4.
A、B 两种化合物的溶液按下列图示完成实验:
4.
A、B 两种化合物的溶液按下列图示完成实验:
(1) 两化合物的化学式A、B分别是:( )
(A) FeCl ,SO
,SO .
(B)FeCl
.
(B)FeCl , K
, K S
S
(C) FeCl , K
, K S
(D) Fe
S
(D) Fe O
O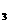 , K
, K S
S
(2) 写出离子方程式:
C→D : FeS + 2H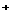 = Fe
= Fe + H
+ H S↑
S↑
请判断:( )
(3) 写出离子方程式:D→E :__________________________. ( )
(A) 2Fe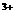 + H_2_S = 2Fe
+ H_2_S = 2Fe + S↓+2H
+ S↓+2H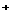
(B) FeS + 2H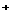 = Fe
= Fe + H2S↑
+ H2S↑
(C) 2Fe + Cl2 = 2Fe
+ Cl2 = 2Fe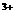 + 2ClH
+ 2ClH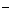
(D) Fe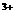 + 3NH3·H2O = Fe(OH)3↓ + 3NH
+ 3NH3·H2O = Fe(OH)3↓ + 3NH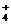
(4) 写出离子方程式: A→F _______________________.( )
(A) 2Fe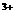 + H2S = 2Fe
+ H2S = 2Fe + S↓+2H
+ S↓+2H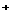
(B) FeS + 2H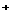 = Fe
= Fe + H2S↑
+ H2S↑
(C) 2Fe + Cl2 = 2Fe
+ Cl2 = 2Fe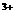 + 2Cl
+ 2Cl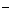
(D) Fe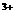 + 3NH3 H2O = Fe(OH)3↓ + 3NH
+ 3NH3 H2O = Fe(OH)3↓ + 3NH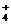
(5) 写出离子方程式:F→G :_____________________________.
Fe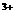 + 3NH
+ 3NH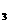 ·H
·H O = Fe(OH)
O = Fe(OH)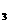 ↓ + 3NH
↓ + 3NH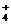
请判断:( )
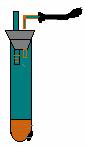 1.
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
1.
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
(1). 波形试管中左液面( ),右液面( ).
(A) 下降,上升。 (B) 上升,下降。
(C) 下降,不变。 (D) 不变,下降。
( )
(2). 试管中液体分为两层,上层呈( )色, 下层呈( )色。
(A) 上层蓝色,下层红色。 (B) 上层红色,下层无色。
(C) 上层蓝色,下层无色。 (D) 上层无色,下层蓝色。
( )
(3). 若在下层溶液中有白色固体沉降出来,则发生反应的化学方程式为:
CuSO4·5H2O
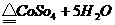
请判断:( )
(4). 若在下层溶液中有蓝色晶体析出,则此蓝色晶体的分子式为:
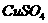 .
.
请判断:( )
2. 实验室制备溴苯的主要步骤如下:
①、在烧瓶中加入4毫升苯和1毫升液溴,并加入少量无锈铁屑。
②、将反应仪器迅速组装好,不需加热,很快发生反应,似沸腾状。
③、将所得产品依次用蒸馏水和5% NaOH 溶液洗涤,再用蒸馏水洗涤便可得到粗溴苯。
(1) 应注意的是:要用(干燥 ) 的烧瓶加入铁屑是起( 催化 )作用。
请判断:( )
(2) 烧瓶口上的导管很长,它是起______的作用。( )
(A)导气、冷凝。 (B)冷凝、回流。
(C)导气、回流。 (D)导气、冷凝、回流。
(3) 用5%的 NaOH 溶液洗涤产品的作用是( 除去溴苯中溶解溴)
请判断:( )
发生反应的化学方程式为:2NaOH + Br = NaBr + NaBrO + H
= NaBr + NaBrO + H O
O
请判断:( )
(4) 纯溴苯是___色,密度比水___,状态为___状___体。( )
(A)粉红色,大,油状,液体。
(B)无色,大,油状,挥发性液体。
(C)无色,大,油状,液体。
(D)无色,大,油状,固体。
26. 某温度下,在100克水中加入m 克CuSO4或加入n克CuSO4·5H2O,均可使溶液恰好达
到饱和,则m和n的关系应符合( )
(A)
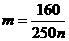 (B)
(B) 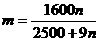
(C)
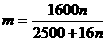 (D)
(D) 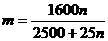
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com