
题目列表(包括答案和解析)
8.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6  CoO2 + LiC6 ,下列说法正确的是
CoO2 + LiC6 ,下列说法正确的是
A.充电时,电池的负极反应为 LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
7.根据盖斯定律判断下图所示的物质转变过程中,正确的等式是

A.△H1=△H2=△H3=△H4 B.△H1+△H2=△H3+△H4
C.△H1+△H2+△H3=△H4 D.△H1=△H2+△H3+△H4
6.对于一定不能自发进行的反应来说,反应后体系的
A.混乱度减少,而能量增加 B.混乱度增大,而能量降低
C.混乱度减少,能量降低 D.混乱度增大,能量增加
5.下列说法或化学用语正确的是(NA表示阿伏加德罗常数)
A.炽热炭与足量浓硝酸反应离子方程式 C +2H+ +3NO3- ==CO2 +3NO2↑+H2O
B.某无色酸性溶液中含有大量Fe2+ H+ Cl- Ca2+ NO3-
C.0.1 mol·L-1的碳酸钠溶液100 mL中含有CO32- 个数小于0.01NA
D.少量潮湿空气进入盛有漂白粉的容器中
Ca(ClO)2 +2CO2 + 2H2O == 2HClO + Ca(HCO3)2
4.Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2==2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有10 mol 电子转移
3、酸根离子RO 所含电子数比硝酸根离子NO
所含电子数比硝酸根离子NO 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
A.R和N为同周期元素
B.R和N是同主族元素
C.RO 和NO
和NO 只可能被还原,不可能被氧化
只可能被还原,不可能被氧化
D.RO 中R元素与NO
中R元素与NO 中N元素的化合价相同
中N元素的化合价相同
2. 白磷(P4)分子呈正四面体结构(如右图所示),科学家受白磷分子的启发,又合成了结构和白磷分子类似的N4分子,下列关于P4和N4分子的说法正确的是
白磷(P4)分子呈正四面体结构(如右图所示),科学家受白磷分子的启发,又合成了结构和白磷分子类似的N4分子,下列关于P4和N4分子的说法正确的是
A.P4和N4是同系物
B.P4和N4是同素异形体
C.P4和N4分子中各原子最外电子层均未达到8电子稳定结构
D.白磷比红磷活泼,N4比N2活泼
1.
 下列化学用语正确的是
下列化学用语正确的是
A.NH3分子的电子式: B.O的核外电子排布:

C.乙烯分子的结构简式:CH2CH2 D.CaCl2的电子式:
30. (15分)某芳香族化合物A发生以下反应:(已知B的相对分子质量为108)有机玻璃的结构简式为
(15分)某芳香族化合物A发生以下反应:(已知B的相对分子质量为108)有机玻璃的结构简式为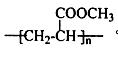 。)
。)
回答下列问题:
(1)A的分子式为 。
(2)G的结构简式 。
(3)B→D的反应类型 ,H-→I的反应类型 。
(4)C→H的反应方程式 。
D→E的反应方程式 。
(5)符合以下条件的M的同分异构体有 种(不包括M)
①含有苯环结构 ②含有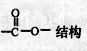
29.(15分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和PCl5 (g)。反应过程和能量关系如图所示(图中的ΔH表示生成lmol产物的数据)。

根据上图回答下列问题:
( l ) P 和Cl2反应生成PCl3 的热化学方程式是_________________________;
( 2 ) PCl5分解成PCl3 和Cl2的热化学方程式是__________________________;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PC15,反应达平衡时PC15还剩0.60 mol,其分解率α1等于________。
(3)P和Cl2分两步反应生成1mol PCl5的ΔH3 =___________________
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com