
题目列表(包括答案和解析)
22、(10分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO 、CO、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是 和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。 a.Br- b.SO c.CH3COO- d.HCO
②将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
③利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论: 。
(3)将Cu投入装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为
20、部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
①滤液A中的阳离子为Fe2+、Fe3+、H+ ②样品中Fe元素的质量为2.24 g
③样品中Fe元素的质量为2.49 g ④样品CuO的质量一定为0.80 g ⑤V=448 ⑥ V=896
A、② B、②④⑤ C、①③⑥ D、②⑤
II卷 52(分)
|
|
|
③B+D===2KCl+MnO2+C↑
⑴ 写出 A、B的化学式:A ;B 。 ⑵ 第①步反应中,氧化产物是 ,
⑶ 第③步反应的化学方程式为 。
19、将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14
的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关
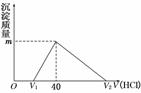 系如图所示,则下列选项正确的是
( )
系如图所示,则下列选项正确的是
( )
A.原合金质量为0.92 g
B.标准状况下产生氢气896 mL
C.图中m值为1.56 g
D.图中V2为60 mL
18、向2毫升0.5摩/升的 FeC13溶液中加入3毫升5摩/升的 KF溶液,发现 FeC13溶液渐渐褪至无色,再加入 KI溶液和 CC14振荡后,静置,不见 CCl4层有紫红色,则下列说法正确的是
A、Fe3+不与I-发生反应 B、Fe3+与 F-结合成不与 I-反应的物质
C、F-使 I-的还原性减弱 D、Fe3+被 F-还原为 Fe2+,使溶液中不再存在 Fe3+
17、向300mL KOH溶液中缓慢通入2.24L(标准状况) CO2气体,充分反应后,在减压低温下蒸发溶液,得到19.4g白色固体。则下列说法中正确的是 ( )
A.此白色固体仅含K2CO3
B.此白色固体是K2CO3和KHCO3的混合物
C.原溶液中含KOH的质量是11.2g
D.原KOH溶液的物质的量浓度是1 mol/L
16、将含1mol HCl的稀盐酸,逐滴加入含0.2 mol NaOH和0.5 mol Na2CO3的混合溶液中,充分反应后溶液中各物质的量是
|
|
HCl/ mol |
NaCl/mol |
NaOH/mol |
Na2CO3 /mol |
NaHCO3 /mol |
|
A |
0 |
1 |
0.1 |
0 |
0.1 |
|
B |
0 |
1 |
0 |
0.1 |
0.1 |
|
C |
0.2 |
0.8 |
0 |
0 |
0.2 |
|
D |
0 |
1 |
0 |
0 |
0.2 |
15、下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )
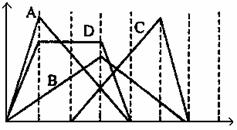
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
14、在含2 mol H2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是 ①放出的气体中除SO2外还有H2 ②反应结束时转移的电子的总物质的量为4 mol
③只放出SO2气体,其物质的量为1 mol ④反应结束后加入KNO3固体Zn粉继续溶解 A.① B.② C.②③ D.②③④
13、已知热化学方程式:2SO2(g)+O2(g) 2SO3(g)△H=-QkJ·mol-1(Q>0)。
2SO3(g)△H=-QkJ·mol-1(Q>0)。
下列说法正确的是
A.相同条件下,2molSO2和1molO2所具有的能量小于2molSO3所具有的能量
B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,
则此过程中有2molSO2(g)被氧化
12、右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23
|
|
X |
|
Y |
|
Z |
|
W |
|
下列说法正确的是
A.X元素最多可形成五种氧化物
B.W元素的非金属性比Z元素非金属性弱
C.Z和X能以共价键结合形成一种无机非金属材料
D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com