
题目列表(包括答案和解析)
2. 下面关于电解质电离的叙述正确的是( )
A.CaCO3在水中溶解度很小,其导电能力很弱,所以 CaCO3是弱电解质
B.CaCO3在水中溶解度很小,但溶解的 CaCO3全部电离,所以 CaCO3是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,水是非电解质
1.以下对化学反应知识的归纳和总结中,正确的是 ( )
A.酸跟活泼金属反应一定生成盐和氢气 B.碱能跟一切非金属氧化物反应
C.单质和化合物的反应一定是置换反 D.置换反应不一定要在溶液中进行
21.(10分)铝是一种重要金属:(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(2)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3
,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

①I和II步骤中分离溶液和沉淀的操作是; ; ②沉淀M中除含有泥沙外,一定还含有 ,固体N是 ;
③滤液X中,含铝元素的溶质的化学式为 ,它属于 (填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入 (填“氨水”或“NaOH溶液”)来制取
A1(OH)3。其反应的离子方程式为:___________________________________________。
交大阳光中学2010-2011学年第一学期
20.(10分)氧化还原综合题:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(5)KMnO4在酸性溶液中发生还原反应的反应式: ______ 。
19.(9分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。

(1)D装置中主要反应的离子方程式为 ,
F仪器的作用是: 。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液 b 氯化亚铁溶液 c硫氰化钾溶液
d 苯酚溶液 e 品红溶液 f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有 (选填一个符号)试剂的试管内,再加入 _ (选填一个符号)试剂,发生的现象是: ;
② 若选用上述试剂中的一种结合必要的操作就可以验证通入C装置中气体是Cl2过量还是SO2过量,该试剂是_________。(选填一个符号)
必要操作和结论______________________________ ________。
18.(8分)推断题:
 已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
(1)写出反应②的化学方程式为_________________________________________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为______________。
(3)反应⑥的离子方程式是___________________________________________。
(4)实验室中保存I的方法是____________________________。
17.(10分)实验室需用浓度为18.4 mol•L-1 浓硫酸配制3.68 mol•L-1 的稀硫酸250mL。填写下列空格。
(1)实验步骤(请补全实验操作过程):
①用量筒取浓硫酸__________mL。
②将浓硫酸慢慢注入盛有少量蒸馏水的小烧杯中,并不断搅拌。
③立刻将稀释后硫酸溶液沿玻璃棒注入容量瓶中。
④用少许蒸馏水洗涤小烧杯,将洗涤液沿玻璃棒注入容量瓶并重复_______次。
⑤继续向容量瓶内小心加蒸馏水,直至距离刻度线__________处。
⑥改用胶头滴管加蒸馏水,使液体的凹液面与刻度线相切。
⑦将容量瓶盖紧摇匀,并将所配溶液装入试剂瓶贴好标签。
上述操作有无不当之处,请指出,并加以改正:__________。
(2)实验中除用量筒、烧杯、胶头滴管、玻璃棒外,还用到的玻璃仪器有_______;
(3)若出现如下情况,对所配溶液浓度的影响是(选填“偏高”、“偏低”或“无影响”);
a.没有进行操作步骤④_______;b.开始时容量瓶没有干燥__________;
(4)其实验过程中出现如下情况应如何处理?
a.定容时加蒸馏水不慎超过了刻度线____________;
b.向容量瓶中转移溶液时(步骤②)不慎有液滴掉在容量瓶外面___________。
16.(8分)已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
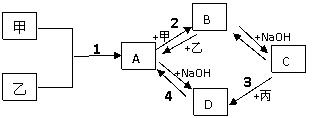
(1)写出下列物质的化学式;乙 ;B 。
(2)写出3反应的化学方程式 。
(3)写出2反应的离子方程式: 。
15. 将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A.2︰3 B.3︰2 C.1︰2 D.1︰1
14. 下列叙述正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.工艺师利用盐酸刻蚀石英制作艺术品
D.已知还原性:Fe2+>Br-可知反应2Fe3++2Br-=2Fe2++Br2不易进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com