
题目列表(包括答案和解析)
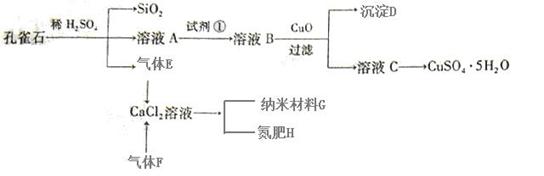
18.(10分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O
及纳米材料G,步骤如下:
 w.w.^w.k.&s.5*高.考.资.源.网
w.w.^w.k.&s.5*高.考.资.源.网
请回答下列问题:
⑴溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 。加入CuO作用是
。
⑵加入试剂①后,溶液中反应的离子方程式,并用单线桥标出电子转移的方向和数目:
⑶制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) (填化学式)。写出该反应的化学方程式 。
⑷欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用 ;取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
17.(12分)⑴有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
⑵高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
。
⑶用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2 L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
|
|
某厂含锌废水水质 |
国家环保标准值 |
|
Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
|
pH |
1-5 |
6-9 |
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为 mg/L,
(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
16. (10分)I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(10分)I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

⑴ 用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
、 。
 ⑵操作Ⅱ的目的是
,
若A为溶液,则A可以是
。
⑵操作Ⅱ的目的是
,
若A为溶液,则A可以是
。

 ⑶写出加入碳酸铵所发生反应的离子方程式:
。
⑶写出加入碳酸铵所发生反应的离子方程式:
。
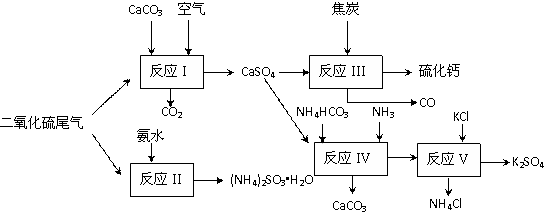
II 以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
w.w.^w.k.&s.5*高.考.资.源.网
⑷已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑸下列有关说法正确的是 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60-70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
⑹反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是
。
⑺(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
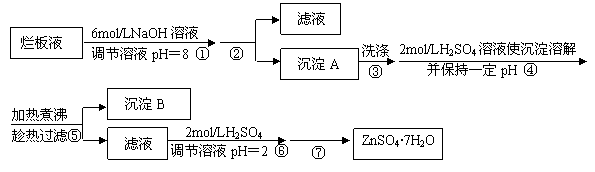
15.(10分)“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下:
w.w.^w.k.&s.5*高.考.资.源.网
已知有关金属离子形成氢氧化物沉淀时的pH见下表:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Zn2+ |
6.4 |
8.0 |
⑴沉淀B的主要成分是 。
⑵第②步操作中需要的玻璃仪器有 。
⑶第④步中pH应保持在 范围内。
⑷第⑥步调节溶液pH=2的目的是 。
⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、 和过滤。
14.将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为100mL D.溶解合金时收集到NO气体的体积为2.24Lw.w.^w.k.&s.5*高.考.资.源.网
非选择题
13.已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶
液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D.FeS、Al(OH)3和S
12.比较氯元素和硫元素的非金属性的相对强弱,下列方案中不能达到目的的是
A.加热条件下,氯气和硫分别与铜反应,比较生成物中铜的化合价
B.比较氯化氢和硫化氢的热稳定性
C.往H2S溶液中通入氯气w.w.^w.k.&s.5*高.考.资.源.网
D.分别测定0.1mol/L氯化钠溶液和0.1mol/L硫化钠溶液的pH
11.金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应:
aTiO2 + bCl2 + cC 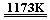 aTiCl4 + cCO ……反应①
aTiCl4 + cCO ……反应①
TiCl4 +2Mg 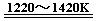 Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是
① TiCl4在反应①中是还原产物,在反应②中是氧化剂;② C、Mg在反应中均为还原剂,被还原;③ 在反应①、②中Mg的还原性大于Ti,C的还原性大于TiCl4;④ a=1,b=c=2;⑤ 每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
10.某无色溶液含有①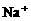 、②
、②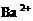 、③
、③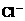 、④
、④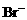 、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
|
步骤 |
操作 |
现象 |
|
⑴ |
用pH试纸检验 |
溶液的pH大于7 |
|
⑵ |
向溶液中滴加足量氯水,再加入CCl4振荡,静置 |
CCl4 层呈橙色 |
|
⑶ |
向所得水溶液中加入足量Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
⑷ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是③④⑥ B.肯定含有的离子是①④⑤
C.不能确定的离子是①③⑤ D.肯定没有的离子是②③⑤
9.下列说法正确的是:
A.已知:熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐
B.单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体
C.分子晶体溶于水时,分子中的化学键可能被破坏
D.BaSO4、CaCO3、Fe(OH)3虽然不溶于水,但是它们均属于强电解质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com