
题目列表(包括答案和解析)
3.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有
A.①③④⑤ B.全部 C.①②⑥ D.②③⑥
2.下列气体中,直接排放到大气而不会产生污染的是
A.NO B.O3 C.CH4 D.CO2
1.亚碘酸钠的化学式为
A.NaI B .NaIO C.NaIO2 D.NaIO3
30、(8分)石油化工排放的废水中常含有多种还原性物质。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
⑴ 配制0.010mo1·L-1标准硫酸亚铁铵溶液500 mL时,需称取硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]的质量为 g。
⑵ 硫酸亚铁铵标准溶液在空气中放置后浓度会发生变化,需用重铬酸钾标准溶液标定硫酸亚铁铵溶液的实际浓度。现取0.0040 mo1·L-1重铬酸钾标准溶液10.00 mL,滴定时,用去25.00 mL硫酸亚铁铵溶液,则硫酸亚铁铵标准溶液的实际浓度为 (K2Cr2O7
的还原产物为Cr3+)。
⑶实际操作中,检测人员在标定标准硫酸亚铁铵溶液浓度时,每次取浓度值为c的重铬酸钾标准溶液10.0 mL,计算时只要测出滴定中消耗的标准硫酸亚铁铵溶液的体积(V,单位mL)就可以依据一个简单的计算式直接计算出标准硫酸亚铁铵溶液的实际浓度。该计算式为 。
杭州学军中学2010学年上学期期中考试
29、(10分)学校化学实验室一试剂瓶标签严重破损,只能隐约看到一些信息,如图所示。
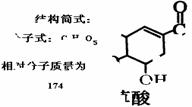
(1)该物质(M)分子式为: ;
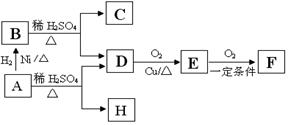 (2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化:
(2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化:
C与F互为同系物,H能使Br2/CCl4溶液褪色,H物质得到的1H-NMR谱中有5个吸收峰。
①A的结构简式为 。
②写出一个证明E中官能团的化学方程式 ,
反应类型 ;
写出C与D反应生成高聚物的化学方程式 ,
③写出与H官能团种类和数目都相同的同分异构体任意两个:
。
28、(10分)针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是 ;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:
;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式: 。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)探究高铁酸钾的某种性质。
[实验1]将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L-1 =10-3 mol·L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
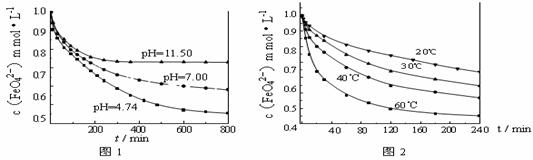
[实验2]将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42-+10 H2O 4
Fe(OH)3 +8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
4
Fe(OH)3 +8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
27、(13分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O
 为原料来制备甲醇。
为原料来制备甲醇。
(1) 将1.0 mol CH4和2.0 mol H2O(g)通入反应室
(容积为100L),在一定条件下发生反应:
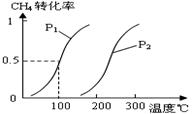
CH4(g)+H2O(g)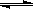 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
① 已知100℃时达到平衡所需的时间为5min,
② 则用H2表示的平均反应速率为_ 。图中的P1_ _P2(填“<”、“>”或“=”),
100℃时平衡常数为_ _。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大” “减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) 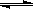 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
 ⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。
|
l
实验编号 |
l
T(℃) |
l
n (CO)/n(H2) |
l
P(MPa) |
|
l
ⅰ |
l
150 |
l
1/3 |
l
0.1 |
|
l
ⅱ |
l
_ _ |
l
_ _ |
l
5 |
|
l
ⅲ |
l
350 |
l
_ _ |
l
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
25、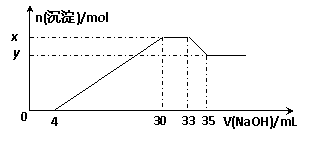 在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是
A.x与y的差值为0.1 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
卷Ⅱ(50分)
24、1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为
A.-Y kJ/mol B.-(10X-Y) kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y) kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com