
题目列表(包括答案和解析)
3.下列关于浓硫酸的叙述正确的是
 A.浓硫酸具有吸水性,因而能使蔗糖炭化
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
2.据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应式中,能表示铁的电化学腐蚀的是
① Fe-2e-=Fe2+ ②2H++2e-=H2↑ ③Fe-3e-=Fe3+
 ④2H2O+O2+4e-=4OH- ⑤4OH--4e-=2H2O+O2↑
④2H2O+O2+4e-=4OH- ⑤4OH--4e-=2H2O+O2↑
A.①②⑤ B.②③④ C.①②④ D.①③⑤
1.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于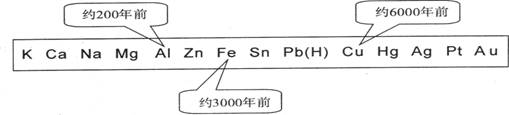
A.金属的化合价高低 B.金属的活动性大小
C.金属的导电性强弱 D.金属在地壳中的含量多少
30.(9分)(I)某同学设计实验探究构成原电池的条件,装置如下:
实验一:实验探究电极的构成〈甲图〉
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;② A、B 两极均选用铜片作电极,发现电流计指针不偏转;③ A极用锌片,B极用铜片,发现电流计指针向左偏转;④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
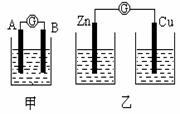
 结论一:____________________________________。
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二 :____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
(II)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。
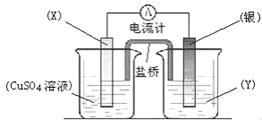
请回答下列问题:(1)电极X的材料是_________;电解质溶液Y是_________;
(2)当电路中转移0.01mol电子时,两电极的质量差为 g。
29.(12分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g) △H = Q1的平衡常数为K1,
FeO(s)+CO(g) △H = Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
|
温度( T ) |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是_______(填“放”或“吸”)热反应;K2的数学表达式为 。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) △H = Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
CO(g)+H2O(g) △H = Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________。
28.(10分)已知有以下物质相互转化
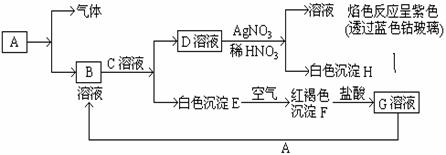
试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)检验G溶液中阳离子存在的试剂是______________。证明存在的现象是 。向G溶液加入A的有关离子反应方程式_________________________。
27.(6分)有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后为无色溶液,在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀全部消失并有气体放出,由此推断: (1)原固体肯定有______________。(2)原固体肯定不存在 。
(3)__________不能确定存在与否,要确定其存在,应进行的实验是_ __ 。
26.(9分)已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为: ,它的共价键属于 (填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为 。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:___________________ ______ ;
X与W形成的化合物与水反应时,水作的是 (填:氧化剂、还原剂)。
25.(5分)已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式相对稳定的是 ;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。该反应的化学方程式为 。
(4) 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
24.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.4mol B.0.3mol C.0.2mol D.0.1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com