
题目列表(包括答案和解析)
27.(1)________________________________________________________
_______________ __________________
(2)__________ ___________________ ____________________
26.(1)________________________
(2)___________________________________________________
(3)①________________ ②________________ ③_______________
30.(9分)用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2  2SO3 △H=-196.6kJ/mol
2SO3 △H=-196.6kJ/mol

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内。
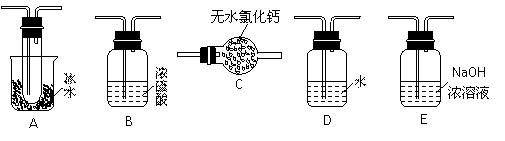
Ⅰ 、Ⅱ 、Ⅲ 。
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是: 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,若用大火加热有Cr2O3处的反应管时,SO2的转化率会 (填升高、降低或不变)
(6)实验时若用25.2g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加13.68g,则本实验中SO2的转化率为 。
三明一中2010-2011学年上学期学段考
高三化学答题卷 考室座位号_______
29.(10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为液体,B为淡黄色固体,J溶于酸得到黄色溶液

请按要求填空:
(1) 写出生成E的电极反应式:
反应⑤的现象是: ___________________
(2) 反应①的化学反应方程式:
在实验室中引发反应④的操作是:
(3) I和G溶液反应的化学方程式:
28. (9分)工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)2沉淀产生;过滤回收沉淀,废水达到排放标准。试回答:
(9分)工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)2沉淀产生;过滤回收沉淀,废水达到排放标准。试回答:
⑴ 电解时的电极反应: 阳极_____________________,阴极______________ 。
⑵ Cr2O72-转变成Cr3+的离子反应方程式
⑶能否用Cu电极来代替Fe电极?______________(填“能”或“不能”),简述理由。
27. (12分)铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:
(12分)铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:
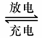 Pb+PbO2+4H++2SO42-
2PbSO4+2H2O
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O
回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变________,当外电路通过1.5mol电子时,理论上负极板的质量增加_______________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
26.(10分)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g)
ΔH>0,
P(g)+Q(g)
ΔH>0,
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为 (填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1 Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1 写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: _________________ 。
(3)在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0
kJ/mol, 测
CH3OH(g)+H2O(g) ΔH=-49.0
kJ/mol, 测
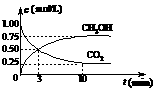 得CO2和CH3OH(g)的浓度随时间变化如右图所示。
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.升高温度 B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入1 mol CO2和3 mol H2
25.用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2 溶液体积(V)间的关系图正确的是

第Ⅱ卷 (非选择题 共50分)
24.为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:
①加水溶解;②加热蒸发结晶;③加入过量氯化钡溶液;④加入过量盐酸;⑤加入过量碳酸钾溶液;⑥过滤。下列操作顺序正确的是
A.①③⑤⑥④② B.①⑤③④⑥② C.①③④⑥⑤② D.①⑤③⑥④②
23.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )  2NH3 ( g ) △H = -92.0
kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H = -92.0
kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
A. 一定小于92.0 kJ B. 一定等于92.0 kJ C. 不能确定 D. 一定大于92.0 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com